SAC : la Surveillance Après Commercialisation des dispositifs médicaux
La surveillance après commercialisation (SAC ou PMS en anglais) est une évolution majeure du règlement (UE) 2017/745 qui, au-delà de la gestion des incidents, vous demande de surveiller de manière proactive le rapport bénéfice / risque de votre produit, durant tout son cycle de vie.
Cet article fait une présentation des exigences générales en SAC, en tenant compte du règlement, des guides MDCG et des normes applicables.
Exigences pour la SAC
Le contexte est posé par le règlement 2017/745 :
- article 83 : Système de SAC mis en place par le fabricant (notez que la SAC implique également les distributeurs et importateurs);
- article 84 : Plan de SAC;
- article 85 : Rapport de SAC;
- article 86 : PSUR;
- article 88 : Rapport de tendance; et
- Annexe III : Documentation Technique relative à la SAC.
Ces activités seront associées aux processus déjà en place selon :
- ISO 13485 : avec ses exigences en matière de mesure, communication, CAPA…
- Guide ISO/TR 20416 avec des techniques de SAC pour les fabricants de DM.
- ISO 14971 : et ses activités de post-production (§9). De manière générale la gestion des risques est très sollicitée : de la définition des indicateurs à l’analyse des données.
- XP S99-223 : gestion du rapport bénéfice risque, définissant les besoins en SAC selon les données, risques et bénéfices clés identifiés.
- ISO 14155 : pour l’investigation clinique et les activités de SCAC (la surveillance clinique, à détailler dans une procédure dédiée).
- IEC 62366-1 : pour définir et surveiller les conditions d’utilisation
Ainsi que normes plus techniques comme la série IEC 60601-1 qui vous seront utiles pour identifier les caractéristiques relatives à la sécurité et aux performances : autant d’indicateurs potentiels pour la SAC.
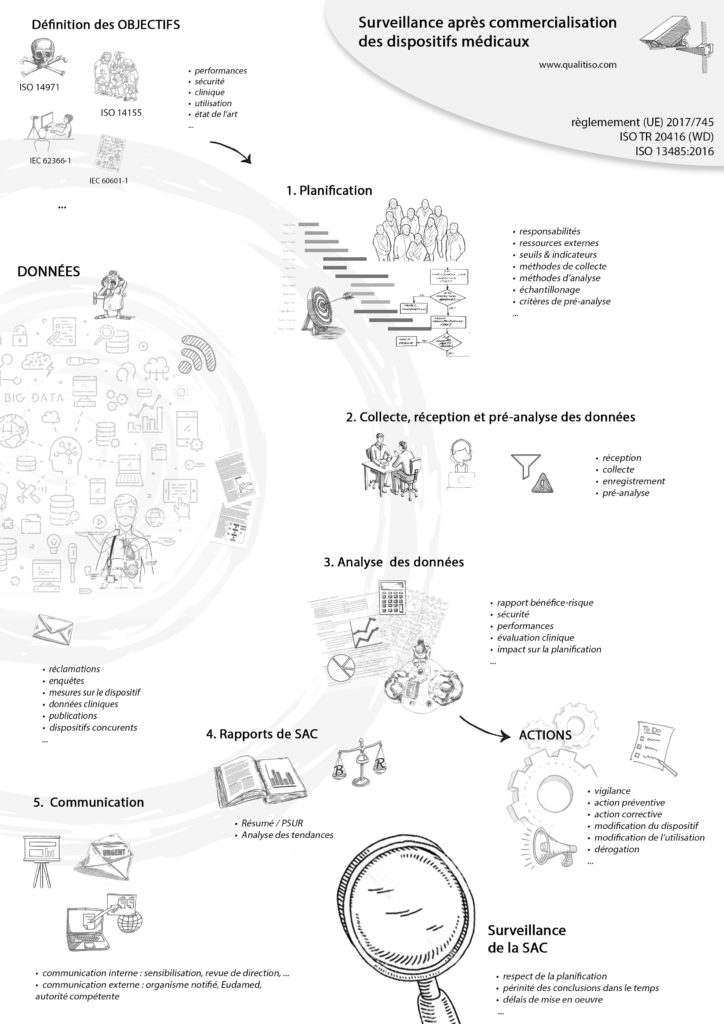
Définition des objectifs de SAC
Les objectifs de surveillance sont identifiés dès la conception :
- Confirmer la sécurité et Performance définis pendant la conception et le développement
- Confirmer les estimations des Risques et bénéfices clés, en gestion du rapport B/R
- Obtenir de nouvelles données cliniques pour lever les incertitudes identifiées durant l’évaluation clinique (la SAC devient alors le SCAC).
- Prendre en compte l’état de l’art qui a alimenté le dossier technique
Planification de la surveillance
La planification se construit autour des objectifs, elle porte sur :
- Les indicateurs et seuils associés à l’objectif
- Les données ciblées : nature, échantillonnage, fréquence…
- Les méthodes de collecte et de réception
- Les critères de préanalyse des données brutes (et sensibiliser les personnes qui recevront les informations des utilisateurs)
- Les méthodes d’analyse des données
- Les responsabilités et ressources nécessaires
- Les informations attendues dans les résumés
- Les besoins en communication des résultats : en interne et vers d’autres organismes
Un travail potentiellement très conséquent … il faudra avoir une approche proportionnée aux risques pour définir un périmètre nécessaire et suffisant au regard des objectifs.
Collecte, réception et préanalyse des données
Notez la distinction collecte / réception, pour insister sur le caractère proactif que doit avoir la SAC.
- Collecte : mesure sur le dispositif, enquêtes utilisateurs, veille technique et clinique, surveillance des dispositifs concurrents…
- Réception : gestion des réclamations et autres remontées spontanées d’information
- Préanalyse : une rapide analyse lors de la réception de données brute (ex : coup de fil d’un utilisateur) doit permettre de détecter une information pertinente pour la SAC, pour que l’information soit immédiatement “aiguillée” vers les acteurs concernés.
Analyse des données de surveillance
Pour identifier un impact sur l’évaluation du rapport bénéfice / risque ou toute autre information pertinente sur le produit, son utilisation et le contexte médical qui l’entoure.
Les résultats et conclusions de l’analyse sont enregistrés.
Actions décidées suite aux analyses
On sort de la surveillance pour lancer d’autre processus :
- gestion des actions correctives et préventives
- communication avec les clients
- modification du dispositif
- modification de l’utilisation prévue
- …
Et pour les cas les plus critiques : actions de vigilance.
Rapports et résumés
Le top management, vos collaborateurs, votre organisme notifié, votre autorité compétente… ne vont pas analyser vos données brutes ni se pencher sur vos rapports d’analyse, ils travaillent sur des résumés produits par les fabricants.
Le règlement demande :
- un simple résumé pour les classes I, à garder dans sa documentation
- un résumé périodique (PSUR) à partir de la classe IIa, à publier sur Eudamed pour les classes III et implantables, dans tous les cas il sera très observé par les votre organisme notifié.
Le contenu du rapport doit permettre de comprendre la SAC réalisée et les faits marquants, on y précisera :
- Champ de la SAC
- Synthèse des résultats et conclusions, notamment sur le rapport bénéfice/risque
- Résumé des actions provoquées par la SAC
- Estimation de l’utilisation du dispositif : nombre d’utilisateurs, fréquence…
Analyse des tendances
Ceci est assez nouveau et mérite des précisions :
- l’analyse de tendance nécessite un nombre conséquent de données
- l’analyse est de nature “graphique” : des représentations dans le temps et autres diagramme de répartition permettent de détecter :
- un motif périodique (ex : une panne tous les 100 utilisations)
- un événement corrélé à une époque de l’année (défaillances pendant les périodes de forte chaleur)
- une tendance à la croissance
- une tendance à l’accélération
- …
En fonction des données disponibles et du niveau de risque l’analyse des tendances sera très simple ou très compliquée, mais c’est un outil puissant : les maths sont aussi pertinentes pour faire des plus-values que pour réduire le taux de morbidité associé à l’utilisation d’un DM.
Communication des résultats
Votre organisme notifié, Eudamed et votre autorité compétente vont s’intéresser à vos rapports.
Les résultats de la SAC seront également communiqués en interne, à l’occasion d’une revue de direction ou pour sensibiliser les collaborateurs.
Surveiller la surveillance
Quelques pistes pour surveiller votre surveillance :
- mesurer l’écart entre votre planification et votre SAC effective
- mesurer les délais de traitement (réception, analyse, mis en œuvre des actions)
- évaluer la pérennité des conclusions au fil du temps
- faire une analyse de cause en cas d’information ratée et détectée après coup
- …

4 commentaires