Rapport bénéfice/risque d’un dispositif médical
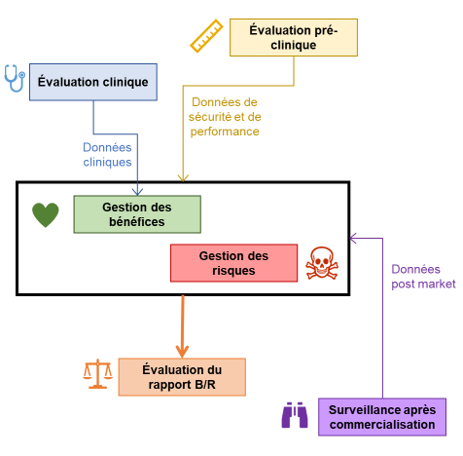
Le nouveau règlement européen relatif aux dispositifs médicaux exige des fabricants qu’ils garantissent un rapport bénéfice/risque favorable pour leurs dispositifs, C’est LE principe à la base de l’acceptation des risques, qui devra être vérifié pendant toute la vie du DM.
Affirmer que les bénéfices sont supérieurs aux risques est un énorme engagement qui va souvent au-delà des compétences initiales du fabricant. Très bien armés vis-à-vis des risques – l’ISO 14971 est là pour ça – les fabricants sont démunis pour comparer risques et bénéfices, avec un constat :
« Unfortunately, there is no standardized approach to estimate benefit » (WD ISO TR 24971:2017).
Décrivez les bénéfices attendus de vos dispositifs
C’est pour offrir ces bénéfices aux patients que vous vous débattez du marquage CE.
Dans le règlement un bénéfice se traduit par un résultat thérapeutique, de diagnostic, ou par une amélioration de la prise en charge de la santé du patient.
Un bénéfice est permis par un phénomène favorable du dispositif qui dans l’utilisation prévue va produire une incidence positive pour le patient, de façon directe ou indirecte. Les données cliniques et pré-cliniques sont utilisées pour prouver le bénéfice.
Vous l’aurez deviné : cette approche reprend les principes de l’ISO 14971 mais « à l’envers ».
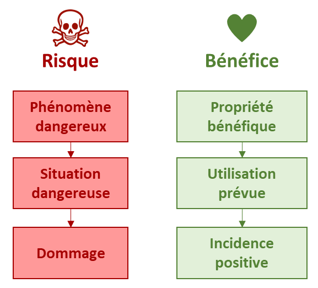
Estimez les bénéfices
Il est vraisemblablement utile d’aller plus loin, avec l’estimation des bénéfices, en caractérisant la probabilité d’occurrence et l’importance, pour évaluer un niveau de bénéfice.
La probabilité dépendra des performances du dispositif, de facteurs humains, ou encore de l’état de santé du patient.
L’importance peut être absolue (le patient est soigné, le diagnostic est possible) ou relative, par comparaison avec les alternatives médicales déjà sur le marché. Elle peut être quantifiée par analogie avec les risques : l’importance d’un bénéfice étant équivalente à la gravité du dommage traité/diagnostiqué/pris en charge.
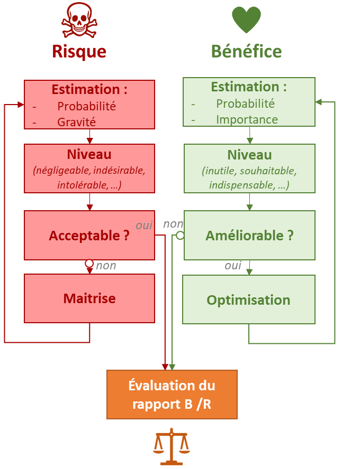
Évaluer le rapport bénéfice / risque d’un dispositif médical
L’analyse du rapport bénéfice risque doit reposer sur des données et répondre à une méthode.
Faites le ménage
En fonction de la complexité de votre dispositif, des risques, des promesses cliniques, des technologies mises en œuvre, … l’analyse peut vite devenir ingérable, il est envisageable d’exclure les risques négligeables et les bénéfices superflus, pour y voir plus clair, ils ont de toute façon un impact très limité sur le bénéfice/risque global.
Analyse pour chaque risque pris individuellement
Avant d’avoir une approche globale il faut s’assurer que les risques pris individuellement sont acceptables au regard des bénéfices.
Pour un risque donné on se limitera aux bénéfices associés à l’utilisation dont il découle.
Les risques devront à minima être maitrisés selon l’état de l’art, normes comprises.
Analyse pour l’ensemble des risques
On réalisera une analyse par utilisation prévue : les bénéfices et les risques associés sont identifiés.
Au besoin, ll faut lister les situations pouvant mener à plusieurs risques simultanés, si le rapport bénéfice / risque est défavorable la vraisemblance des situations est débattue. Mais la plupart des analyses peuvent considérer l’ensemble des risques, surtout les plus faible, sans travail de tri préalable.
Et si ça coince ?
Vous aurez deux leviers : réduire le niveau de risque (vous le faite dans le cadre de la 14971) et optimiser le niveau de bénéfice.
On pourra améliorer un bénéfice en travaillant sur des conditions d’utilisation plus adéquates, sur les performances du produit, ou sur une meilleure formation des utilisateurs.
Retour en gestion des bénéfices risques, les mesures décidées vont impacter la conception du dispositif, voire l’utilisation prévue.
Il y a une surveillance après le CE
Le contexte technique, les usages, les alternatives, les consensus, sont en perpétuelle évolution, une amélioration continue est donc justifiée.
Les risques et les bénéfices sont suivis proportionnellement à leurs niveaux, le rapport B/R est réévalué à chaque nouvelle information pertinente collectée : nouvelles données sur les performances techniques, incident, nouveau consensus médical, évolution des usages, nouvelles alternatives médicales… Ceci pour apporter une réponse aux obligations de surveillance (clinique) après commercialisation du nouveau règlement.
Conclusion
Le défi est grand pour les fabricants, évaluer le rapport bénéfice risque d’un dispositif médical implique des considérations techniques, cliniques, humaines, mais aussi économiques, sociales voire politiques … qu’il vous faudra résumer à favorable ou défavorable. Un travail autour des bénéfices et une formalisation de l’analyse du rapport B/R semblent nécessaires pour répondre aux exigences d’avant et d’après mise sur le marché.

7 commentaires