Les procédures de certification d’un dispositif médical, selon le Règlement (UE) 2017/745
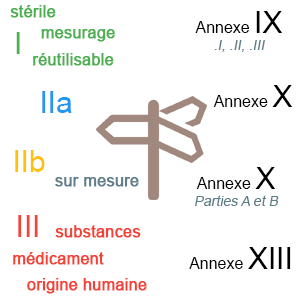
Liste des différentes procédures de certifications applicables avec le règlement 2017/745, à choisir en fonction de la classe de vos dispositifs.
Les annexes définissant les procédures de certification
Le règlement comporte quatre annexes qui décrivent les différentes procédures de marquage CE :
- Annexe IX : Évaluation de la conformité sur la base d’un Système de Management de la Qualité (SMQ) et de l’évaluation de la Documentation Technique (DT).
- Annexe X : Examen de type
- Annexe XI : Vérification de la conformité du produit
- Annexe XIII : pour les dispositifs sur mesure
Annexe IX : Évaluation de la conformité sur la base d’un SMQ et de l’évaluation de la DT
La voie royale pour le marquage CE, c’est la plus utilisée pour les classe IIa et IIb, le pendant de l’annexe II de la directive 93/42.
Elle inclut trois parties, applicables ou non en fonction de la classe :
- IX.I : SMQ : évaluation, audit, surveillance par l’ON
- IX.II : Évaluation de la Documentation Technique :
- IX.4 : procédure pour les classes IIb et III
- IX.5 : procédures spéciales :
- IX.5.2 : dispositif incorporant une substance médicamenteuse
- IX.5.3 : organes, tissus, cellules, … d’origine humaine ou animale
- IX.5.4 : substance absorbée ou dispersée par le corps humain
- .6 : vérification de lot (pour les DM combinés, la vérification est réalisée par un labo)
- IX.III : dispositions administratives
Annexe X : Examen de type
Dans la continuité de l’annexe III de la directive : un organisme notifié vérifie que le dispositif, sa documentation technique et les processus en place sont conformes aux exigences du règlement, en s’appuyant notamment sur un échantillon représentatif de la production.
Annexe XI : vérification de la conformité du produit
Deux parties, à comparer aux annexes V (pour la partie A) et IV ( pour la partie B) de la 93/42/CEE.
- Partie A : assurance qualité de la production
- Partie B : vérification de chaque dispositif fabriqué
Les procédures par classes et particularités
Classes Is, Im, Icr, IIa, IIb et III
Remarque, les dispositifs de classe I concernés sont les dispositifs stériles (Is), intégrant une fonction de mesurage (Im) ou les instruments chirurgicaux réutilisables (Ic.r). Le SMQ est alors limité à l’aspect “spécial”.
| CLASSE | Annexe IX | Annexe X | Annexe XI | |||
|---|---|---|---|---|---|---|
| SMQ et évaluation de la DT | Examen de type | Vérification du produit | ||||
| I, III | II.4 * | tout | Partie A | Partie B | ||
| SMQ | DT | AQ prod | Verif. produit | |||
| Is, m, c.r (smq limité) |
X | |||||
| X | ||||||
| IIa | X | X | ||||
| X + DT | ||||||
| X + DT | ||||||
| IIb | X | X | ||||
| X | X | |||||
| X | X | |||||
| III | X | |||||
| X | X | |||||
| X | X | |||||
Concernant l’évaluation de la documentation technique selon l’annexe IX.II.4 elle est plus ou moins étendue en fonction de la classe du DM :
- IIa: évaluation par catégorie de dispositif
- IIb: évaluation par groupe de dispositif
- IIb implantable et classe III : évaluation de tous les dispositifs
Dispositifs médicaux particuliers
Valable pour les DM combinés (exigences en plus de la procédure choisie pour de classe III) et sur mesure :
| Types de DM | Annexe applicable |
|---|---|
| Intégrant un médicament (dont l’action est accessoire) | IX.II.5.2 |
| Fabriqué à l’aide de (dérivés de) tissus / cellules humaines ou animale | IX.II.5.3 |
| Composés de substances ou de combinaisons de substances destinées à être introduites par un orifice du corps ou par application sur la peau et absorbées ou dispersées localement | IX.II.5.4 |
| Sur mesure | XIII |
| Sur mesure implantable de classe III | XIII + (IX.I ou XI.A) |

5 commentaires