Guide pour l’investigation clinique : Revue des modifications
L’IMDRF a mis à jour son guide lié à l’investigation clinique. Il s’agit d’une mise à jour ayant pour base la version de 2010 (GHTF/SG5/N3:2010) qui était encore sous format GHTF, l’ancêtre de l’IMDRF.
Revue des modifications
Outre la prise en considération de la version la plus récente de la norme ISO 14155:2019, le guide prend en compte les nouvelles définitions ainsi que les nouveaux travaux et guides publiés par l’IMDRF.
Les fabricants doivent maintenant considérer le besoin de lancer de nouvelles investigations cliniques à la lumière de nouvelles questions de sécurité ou performance clinique liées à leurs dispositifs médicaux, notion qui était absente de la précédente version.
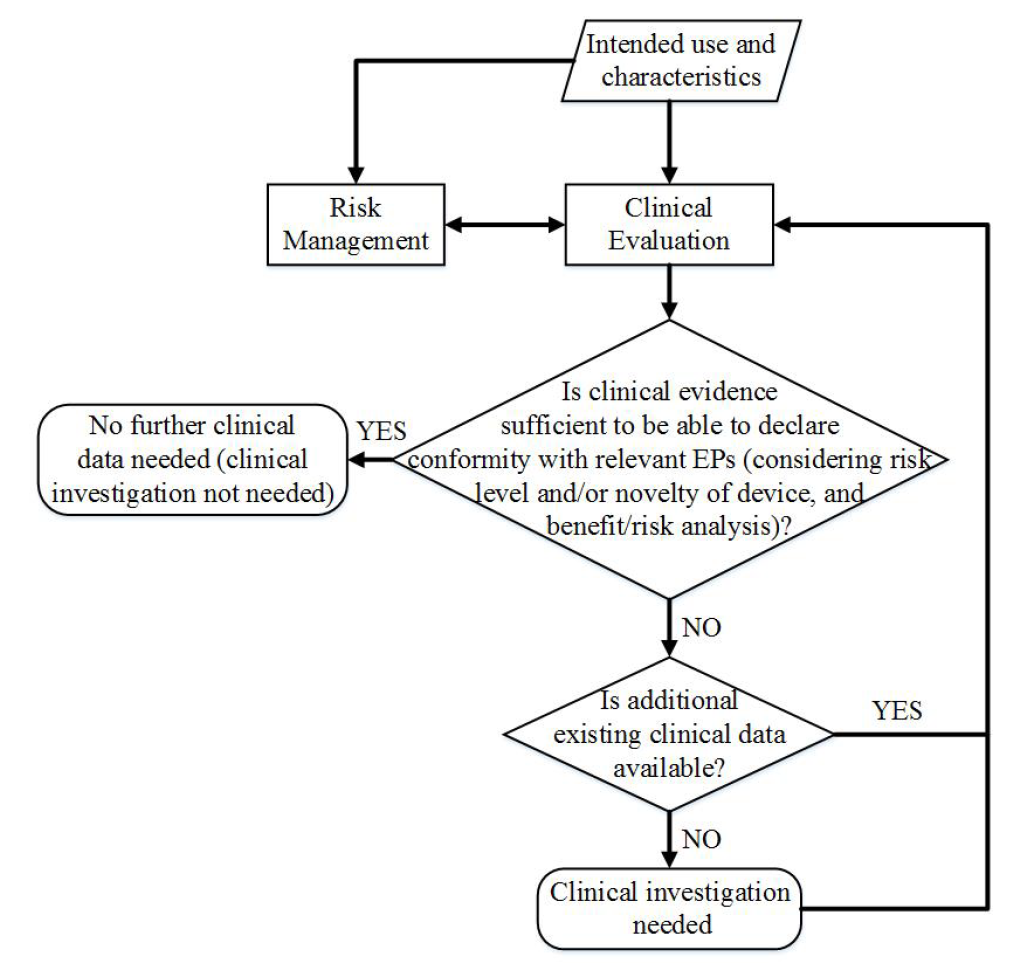
Le guide présente maintenant le besoin d’évaluer de le rapport bénéfice/risque comme facteur à considérer avant le lancement d’une investigation clinique. Ce questionnement est repris dans le logigramme suivant :
Les données nécessaires pour l’établissement du protocole d’investigation clinique ont également été mises à jour, avec l’ajout d’exigence telles que les procédures prévues pour la gestion des abandons ou de données manquantes …
Il est également maintenant suggéré de prendre en compte les courbes d’apprentissage anticipées des utilisateurs dans les protocoles.
Il est également précisé que les investigations cliniques multirégionales sont réputées pouvoir garantir un accès précoce aux différents marchés, ce qui ne surprendra personne.
Source : IMDRF