Qualitiso • Le site des Dispositifs Médicaux
Bienvenue sur Qualitiso
Le site des Dispositifs Médicaux
Article au hasard
Contenu par sujets
Cliquez pour dérouler les menus
Veille, normes et documents
Sélection d’articles
Templates
Forum
Réglement (ue) 2017/745
Sélection d’articles
Templates
Vidéos
Système de Management de la Qualité
Sélection d’articles
Templates
- 📄 Document • Manuel Qualité
- 📄 Document • Suivi des NC, CAPA
- 📄 Document • Suivi Des Actions
- 📅 Plan • Conception et Développement
- ▶️ Procédure • Approche par les Risques
- ▶️ Procédure • Audits
- ▶️ Procédure • Conception et Développement
- ▶️ Procédure • Gestion des Achats
- ▶️ Procédure • Gestion des Documents
- ▶️ Procédure • Gestion des Équipements
- ▶️ Procédure • Gestion des Exigences des Clients
- ▶️ Procédure • Gestion des Modifications
- ▶️ Procédure • Gestion des Ressources Humaines
- ▶️ Procédure • Identification et Traçabilité
- ▶️ Procédure • Infrastructures et Environnement de Travail
- ▶️ Procédure • Marketing et contact commercial
- ▶️ Procédure • Mesures, Analyse et Amélioration
- ▶️ Procédure • Non-Conformités et CAPA
- ▶️ Procédure • Production et Prestations de service
- ▶️ Procédure • Revue de Direction
- ▶️ Procédure • Service Après-Vente
- ▶️ Procédure • Validation de la Production
- ▶️ Procédure • Validation des Logiciels du SMQ
- 🔎 Revues • Conception et Développement
- ❎ Spécification • Exigences sur le Dispositif
Forum
Documentation Technique et Informations fournies
Sélection d’articles
Templates
Gestion des Risques et Aptitude à l’Utilisation
Sélection d’articles
- Introduction à la norme ISO 14971
- L’ISO 14971 à l’heure du règlement
- Le dossier de gestion des risques
- Guide pour construire une analyse des risques
- Identification des risques des DM
- Estimations et suivi des probabilités
- Résumé de la norme XP S99-223
- Visualisation des données pour l’analyse B/R
- Résumé de la norme IEC 62366-1
- Exemples d’erreurs d’IAU
Templates
- ▶️ Procédure • Gestion des Risques
- ▶️ Procédure • Analyse des Risques et du rapport B/R
- 📄 Document • Analyse des risques
- ▶️ Procédure • Ingénierie de l’Aptitude à l’Utilisation
- 📓 Dossier • Gestion des Risques
- 📅 Plan • Gestion des Risques
- 📅 Plan • Ingénierie de l’Aptitude à l’Utilisation
- 📓 Rapport • Évaluations d’IAU
- 🔎 Revues • Gestion des Risques
- 🔎 Revues • Ingénierie de l’Aptitude à l’Utilisation
Logiciel et Électronique
Sélection d’articles
- Logiciels médicaux et Règlement DM
- Résumé de la norme IEC 62304
- Cybersécurité des dispositifs médicaux
- Résumé de la norme IEC 82304-1
- Marquage CE d’un dispositif électro-médical
- Les classes, types et groupes de D-EM
- Résumé de la norme IEC 60601-1
- Résumé de la norme IEC 60601-1-11
- Mémo : Les alarmes des dispositifs médicaux
Templates
- ▶️ Procédure • Cycle de Vie du Logiciel
- ▶️ Procédure • Gestion de la Cybersécurité
- ▶️ Procédure • gestion de la Sécurité Électrique
- ❎ Exigences • Essais selon la norme 60601-1
- ❎ Spécification • Architecture Logicielle
- ❎ Spécification • Exigences Logiciel
- ❎ Spécification • Fichier de Configuration du Logiciel
- ❎ Spécification • Unités Logicielles
- 📅 Plan • Développement du Logiciel
- 📅 Plan • Test du Logiciel
- 📓 Rapport • Test du Logiciel
- 🔎 Revues • Gestion du Cycle de Vie du Logiciel
Evaluations Biologiques et Cliniques
Sélection d’articles
Templates
Post-Market
Sélection d’articles
Templates
- ▶️ Procédure • Suivi Clinique Après Commercialisation
- 🗃️ Codes IMDRF des Effets indésirables
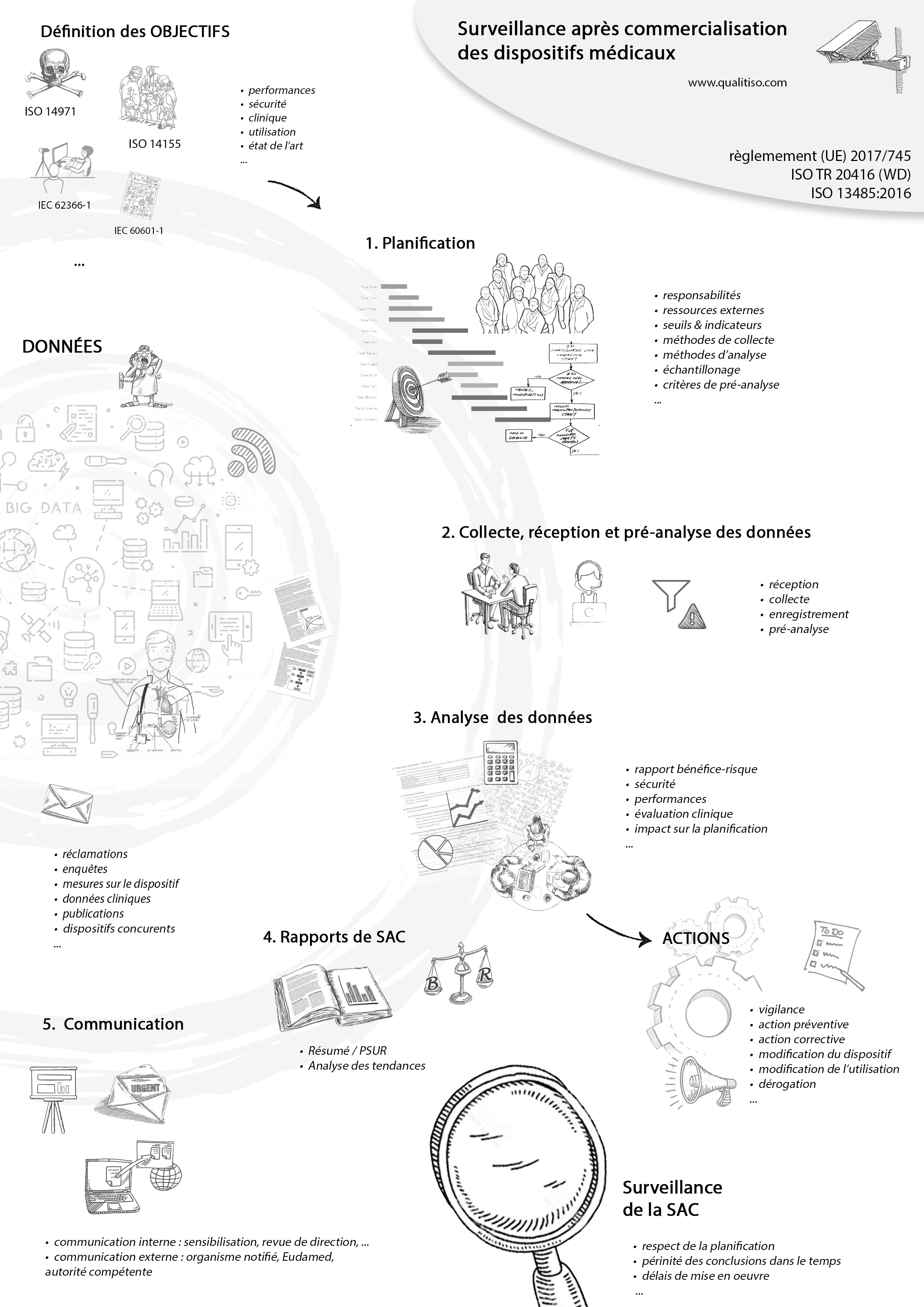
- ▶️ Procédure • Surveillance Après Commercialisation
- ▶️ Procédure • Vigilance
- 📅 Plan • Suivi Clinique Après Commercialisation
- 📅 Plan • Surveillance Après Commercialisation
- 📓 Rapport • Periodic Safety Update Report
- 📓 Rapport • Suivi Clinique Après Commercialisation
- 📓 Rapport • Surveillance Après Commercialisation
Autres sujets
Sélection d’articles
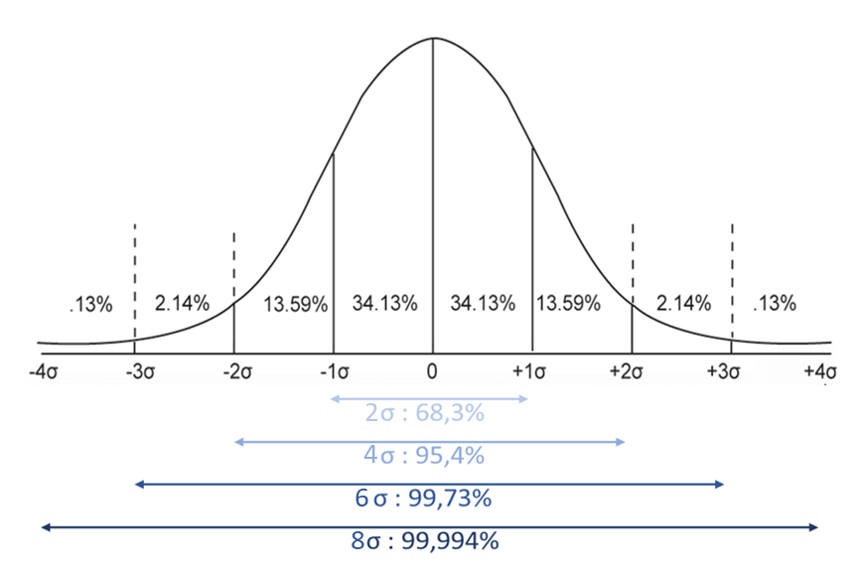
- Généralités sur la notion de Risque
- Covid-19 • Analyse et suivi dans le temps
- L’IA utilisée pour le médical
- L’impression 3D utilisée pour le médical
- Considérations environnementales les DM
- Les règlementations environnementales applicables
- Les normes pour le management environnemental
- Les principaux risques dans le monde
- Risques associés au changement climatique
- Un monde en 2100
Activité récente
accueil accueil
- Feed has no items.