SCAC : le Suivi Clinique Après Commercialisation
Le suivi clinique après commercialisation est une exigence réglementaire majeure, visant à mettre à jour vos évaluations cliniques en continu.
Les méthodes et résultats attendus présentés ci-dessous sont définis dans le règlement (UE) 2017/745 et les guides MDCG associés.
Le SCAC pour consolider l’évaluation clinique
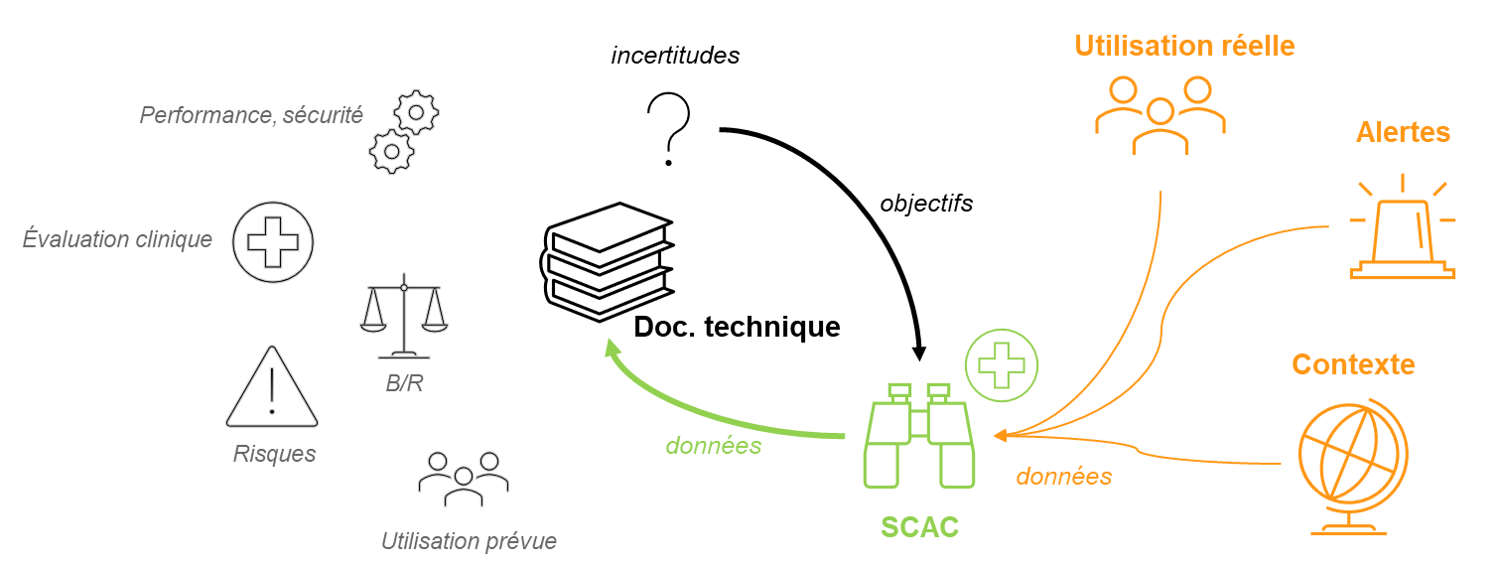
L’objectif du SCAC est clair : lever les incertitudes autour de votre évaluation clinique. La conclusion de votre évaluation clinique est donc la principale donnée d’entrée pour planifier le SCAC, les incertitudes identifiées sont autant de pistes pour définir les objectifs du suivi.
Le suivi clinique sera dense les premières années, particulièrement pour un dispositif innovant en manque de données liées à son utilisation, à sa sécurité et à ses performances.
Une fois le dispositif et son utilisation maitrisés le besoin est moins important, mais le contexte peut évoluer et de nouvelles informations pourraient changer vos conclusions !
Aussi, le SCAC se prolonge durant tout le cycle de vie du dispositif, il prend en compte les informations sur le dispositif et sur le contexte associé.
Notez qu’il est exceptionnel de ne pas faire de SCAC, c’est possible uniquement si les performances et l’utilisation du dispositif sont maitrisés depuis longtemps, avec des dispositifs équivalents. À l’inverse, dans le cas des DM de classe III ou implantables, vous pouvez planifier un SCAC pour justifier auprès de votre ON de ne pas faire d’investigation clinique pré-CE.
Définir les objectifs de SCAC
Dans le cadre du suivi clinique les objectifs sont des classiques du règlementaire :
- Confirmer la sécurité et les performances, pendant toute sa durée de vie prévue ;
- Surveiller les effets secondaires et les contre-indications ;
- Identifier les risques émergents ;
- Identifier toute mauvaise utilisation systématique ;
- Identifier et surveiller toute utilisation hors destination prévue ; et
- Confirmer que le rapport bénéfice/risque reste acceptable.
Et ce, avec des données cliniques.
Ces objectifs ne sont pas spécifiques au SCAC : on les retrouve dans les activités (et normes) suivantes :
- Sécurité & Performances : Conception et développement (ISO 13485)
- Effets secondaires : Évaluation clinique, dont investigation (ISO 14155)
- Nouveaux risques : Gestion des risques (ISO 14971)
- Mauvaise utilisation : Ingénierie de l’aptitude à l’utilisation (IEC 62366-1)
- Utilisation hors utilisation prévue : Ingénierie de l’aptitude à l’utilisation (IEC 62366-1) voire en dehors de votre responsabilité si cela est intentionnel
- Acceptabilité du rapport B/R : Gestion du rapport bénéfice/ risque (XP S99-223)
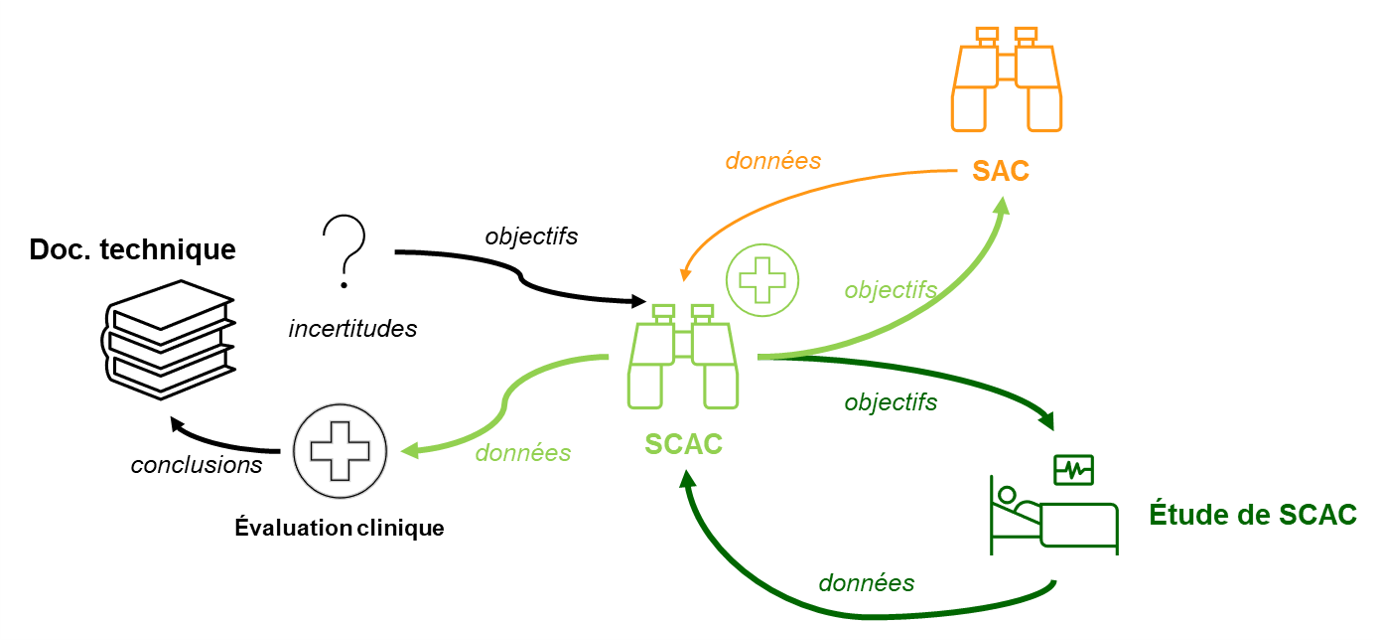
Le SCAC est donc la partie clinique immergée de l’iceberg SAC.
Méthodes “générales” de SAC applicables au SCAC
Le SCAC est une sous-composante du SAC dédiée aux données cliniques, de nombreuses méthodes “générales de SAC” peuvent alimenter le SCAC :
Parmi les méthodes générales :
- Consultation de la littérature scientifique et autres sources de documentation cliniquement pertinentes : recommandations, normes, guides, nouvelles pratiques ;
- Surveillance des dispositifs équivalents ;
- Collecte et analyse des données de l’expérience clinique acquise ;
- Collecte des cas d’utilisation du dispositif hors destination prévue ;
- Collecte et analyse des cas d’utilisation du dispositif dans le cadre d’un usage compassionnel ou humanitaire (contexte où le B/R justifiait une utilisation hors conformité réglementaire) ;
- Collecte et analyse des données du retour d’information des utilisateurs, patients comme professionnels (dont plaintes, enquêtes) ;
- Analyse des données issues d’autres activités de SAC.
Méthodes “particulières” de SCAC
Il peut être nécessaire de planifier une étude / investigation de SCAC, en complément des activités générales. Une décision évidement lourde, qu’il faudra gérer comme toute étude clinique.
Parmi les circonstances tendant à faire une étude clinique de suivi :
- Demande de l’organisme notifié ;
- Incertitudes sur les risques, les bénéfices, la bonne utilisation ;
- Élargissement de la population cible ;
- Innovation technologique ;
- Usage innovant ;
- Population civile à haut risque ;
- Dommages potentiels importants.
Ce sont les conclusions de vos activités de gestion des risques, d’évaluation clinique et d’évaluation du bénéfice/risque qui dictent les nécessités.
Parmi les méthodes particulières relevant des “études de SCAC” :
- Investigations cliniques
- Suivi de cohorte de patients
- Revue des registres, bases, publications cliniques
- Enquête impliquant la personne humaine
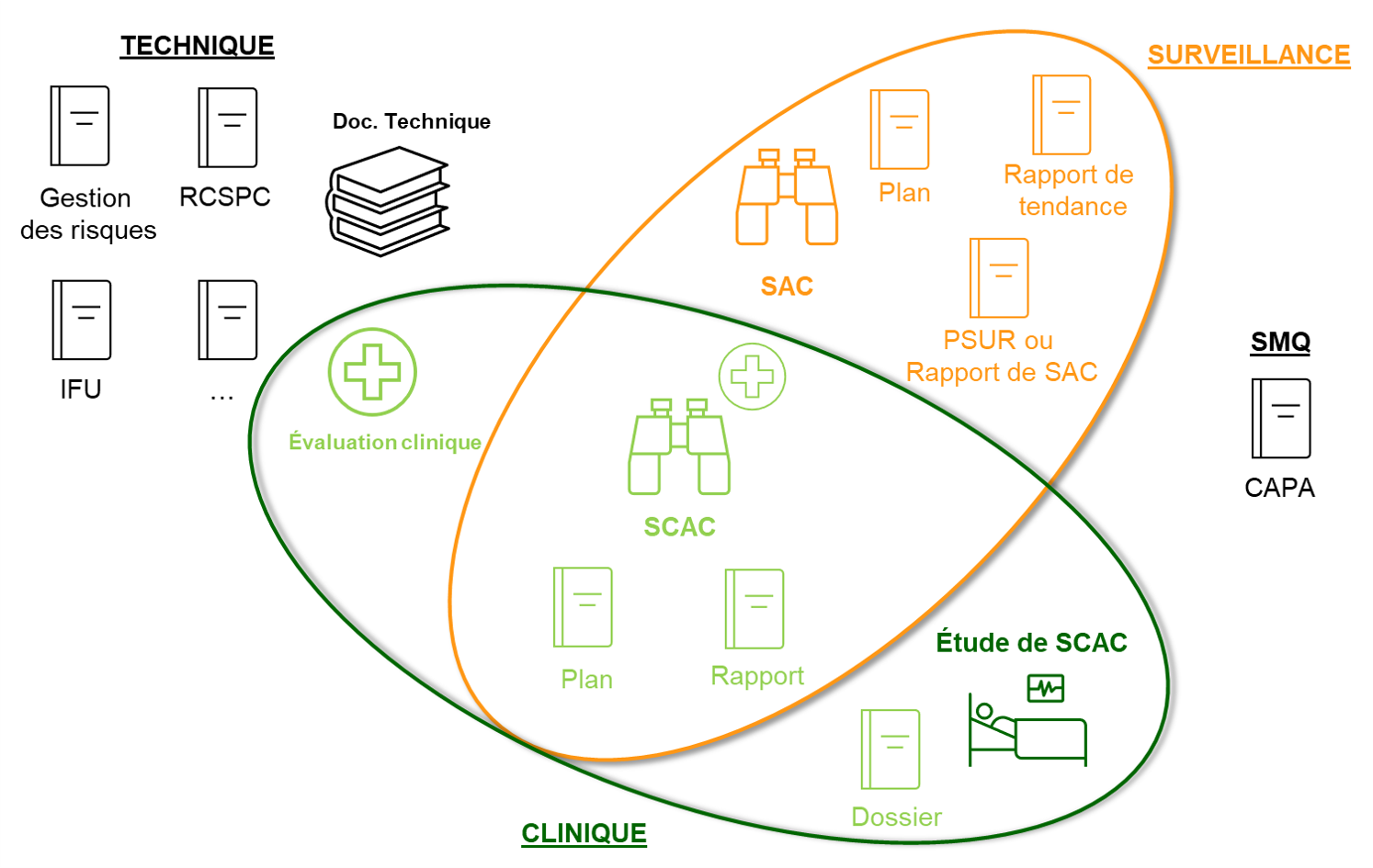
Les documents attendus
Pour répondre aux exigences de SCAC il faudra produire, pour chaque dispositif :
- Une planification de la SCAC.
- Un rapport d’évaluation du SCAC, inclus dans le rapport d’évaluation clinique, lui-même inclus dans la documentation technique.
- Le suivi des actions préventives et correctives décidées suite à SCAC.
Vos activités de SCAC nourriront également votre PSUR et votre RCSPC. En fonction des actions décidées cette surveillance peut également conduire à modifier le dispositif, son utilisation ou les informations fournies.
Notez que le plan de SCAC, comme le PSUR, doivent être des documents autoporteurs, pouvant être lu sans aucun autre document. Ils contiennent donc beaucoup d’informations déjà présentes de votre documentation technique, notamment dans le dossier de gestion des risques, l’évaluation clinique ou a liste des référentiels appliqués.
Qui fait quoi ?
C’est une grosse difficulté avec le SCAC : savoir qui fait quoi.
Le suivi clinique est à la croisée de l’évaluation clinique et de la surveillance générale.
Les fabricants ont très souvent recours à une personne dédiée au clinique, et il est rare que les autres personnes de l’équipe “parlent le clinique“.
Pourtant, SAC et SCAC partent des mêmes besoins et impliquent souvent les mêmes sources de données.
Il est capital que le responsable clinique sensibilise l’équipe, en faisant le lien entre le besoin clinique et les autres activités de l’entreprise : les données cliniques vont confirmer les hypothèses du bureau d’étude, lever les doutes de la gestion des risques, prouver la bonne aptitude à l’utilisation… le SCAC va également impacter le traitement des informations clients, qui sont susceptibles d’être de nature clinique.
Le SCAC est une activité multi-processus et multi-intervenants, des interactions claires sont nécessaires.
Articles connexes
- Évaluation clinique des dispositifs médicaux
- Surveillance après commercialisation des dispositifs médicaux
- Gestion du rapport bénéfice/risque des dispositifs médicaux
- Seuils en indicateurs pour la surveillance après commercialisation
- PSUR : le Rapport Périodique Actualisé de Sécurité
- Suivi des guides MDCG

2 commentaires