ISO 13485 – Liste des procédures obligatoires

La norme ISO 13485:2012 définit les exigences en matière de système de management de la qualité (SMQ) pour un organisme fournissant des dispositifs médicaux (DM) ou des services associés.
C’est une norme harmonisée, sa mise en œuvre permet de répondre à certaines exigences de la directive 93/42/CEE: la directive Européenne sur les DM.
Appliquer l’ISO 13485 passe par des procédures à intégrer au SMQ, la norme en exigence une vingtaine auxquelles s’ajouteront celles nécessaires à vos activités.
La notion de procédure dans l’ISO 13485
Vous ne trouverez pas de définition de procédure dans l’ISO 13485, elle vous renvoie à l’ISO 9000:
Procédure : manière spécifiée d’effectuer une activité ou un processus
L’ISO 13485 parle de procédures documentées (les spécifications sont définies dans des documents). Le cycle de vie de ces procédures est le suivant:
- Établir la manière d’effectuer l’activité.
- Créer le document, le revoir, le vérifier et le valider.
- Mettre en œuvre la procédure.
- Tenir à jour la procédure en fonction des évolutions de l’activité, des améliorations détectées…
Liste des procédures obligatoires de l’ISO 13485
Cette liste repose sur la version NF EN ISO 13485:2012, elle sera mise à jour avec la version 2016.
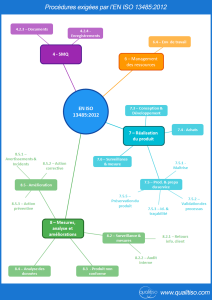
Les procédures sont données dans l’ordre de la norme, l’objectif et une partie du contenu attendu sont donnés à titre indicatif.
Comme pense bête, l’illustration ci-dessous montre les chapitres de la norme qui exigent une (des) procédure(s) documentée(s).
1 – Maîtrise des documents (4.2.4)
- Objectif: garder la maîtrise des documents du SMQ
- Contenu: système d’identification, modalités de rédaction, revue, révision, approbation, diffusion, archivage, contenu “minimal” (titre, référence, date, auteur,..), …
Notez que certains documents sont d’origine externe, c’est le cas des documents réglementaires et normatifs.
Les documents peuvent être “sur papier” ou numériques.
2 – Maîtrise des enregistrements (4.2.5)
Un enregistrement est un document particulier, citons l’ISO 9000:
Enregistrement: document faisant état de résultats obtenus ou apportant la preuve de la réalisation d’une activité
- Objectif: garder la maîtrise des enregistrements utilisés pour: établir la conformité du SMQ aux exigences et établir son fonctionnement efficace
- Contenu: comparable aux documents, on insistera sur les dates à ne pas anti/post dater, l’identité de l’auteur à garantir, la sauvegarde des données brutes transformées pour l’enregistrement…
3 – Environnement de travail (6.4)
Le §6.4 fait partie du §6: “Management des ressources”, la procédure est nécessaire lorsque l’environnement de travail peut avoir un impact sur la qualité des produits.
- Objectif: surveiller et maîtriser les conditions d’environnement de travail
- Contenu: dépends de l’activité du fabricant, peut traiter de la sécurité du personnel (surveillance des installations électriques, des protections incendie,..), des locaux (maintenance d’une salle blanche..) , des conditions climatiques…
4 – Conception et développement (7.3)
Un gros morceau, la norme parle d’ailleurs de procédures documentées, au pluriel donc.
En plus d’une procédure propre à la R&D d’autres viennent en complément, elles sont souvent appelées par d’autres normes applicables aux DM: activités de gestion des risques (ISO 14971), développement des logiciels médicaux (IEC 62304) , évaluation de l’aptitude à l’utilisation (IEC 62366-1)…
- Objectif: avoir un processus de conception et développement conforme aux exigences
- Contenu: toutes les étapes doivent être définies: gestion des données d’entrée, revue, vérification et validation, modification…
5 – Processus d’achat (7.4.1)
- Objectif: acheter des produits conformes aux exigences définies
- Contenu: notion de produit critique, modalité de définition des exigences d’achat, vérification des achats, sélection et surveillance des fournisseurs…
6 – Maîtrise de la production et de la préparation du service (7.5.1)
Ces procédures ont une finalité très technique, chaque produit ou service en nécessite souvent plusieurs. Elles doivent être non ambiguës et faciles à mettre en œuvre, elles sont souvent illustrées de logigrammes, de photo…
- Objectif: maîtriser les activités de production et de préparation de service
- Contenu: dépends du produit/service considéré
7 – Validation des processus de production et de préparation du service (7.5.6)
En cas très particulier, applicable pour les procédés de stérilisation mais aussi pour une application logicielle utilisée pour la prod / la préparation de service et qui affecte la capacité du produit à répondre à ses exigences sans que cela ne soit détectable en fin de prod / de préparation.
Notez que dans le projet de norme PR NF EN ISO 13485:2015 généralise cette procédure à tous les processus à valider, dans ce cas:
- Objectif: démonter l’aptitude des processus de production / de préparation de service à obtenir les résultats attendus
- Contenu: critères d’approbation, qualification des équipements et du personnel, exigences sur les enregistrements…
8 – Identification et traçabilité (7.5.8 et 7.5.9)
- Objectif: identifier le produit au fil de sa réalisation ainsi que les DM retournés. Assurer la traçabilité.
- Contenu: codification des numéros de série / de lot, enregistrements, identification en fonction de l’état / de la finalité (produits commercialisé, produits de démo…)…
9 – Préservation du produit (7.5.5)
- Objectif: assurer la conformité du produit au cours d’opérations internes et lors de la livraison.
- Contenu: modalités de transport, de stockage, de manutention, … protections contre les décharges électrostatiques, maintiens des conditions environnementales…
10 – Maîtrise des dispositifs de surveillance et mesure (7.6)
- Objectif: assurer la cohérence entre les activités de surveillance/mesure et les exigences associées
- Contenu: surveillance des instruments de mesure (fiche de vie, étalonnage,..), maintiens des performances métrologiques,..
Remarque: les logiciels sont également concernés.
11 – Retours d’information du client (8.2.1)
- Objectif: avoir un retour d’information des clients, pour prendre en compte les problèmes détectés
- Contenu: identification des sources d’information, responsabilités, moyens de collecte des infos, périodicité,..
12 – Audit interne (8.2.2)
- Objectif: évaluer la bonne mise en œuvre, la conformité et la maintenance du SMQ
- Contenu: programmation des audits, choix des auditeurs, méthodes d’audit…
13 – Maîtrise du produit non-conforme (8.3)
- Objectif: empêcher l’utilisation non intentionnelle de produits non-conformes
- Contenu: enregistrement, mise à l’écart, analyse des causes, actions induites…
14 – Analyse des données (8.4)
- Objectif: utiliser des données pour “suivre” le SMQ
- Contenu: détermination des données, modalités de collecte, d’analyse,..
15 – Amélioration (8.5.1)
- Objectif: gérer les fiches d’avertissement et, le cas échéant, la communication avec les autorités réglementaires
- Contenu: modalités de communication et de mise en œuvre des fiches, modalités de notification aux autorités,..
16 – Action corrective (8.5.2)
- Objectif: éliminer les causes de non-conformité (NC)
- Contenu: revue des NC, analyse des cause, décision de lancer des actions, enregistrements, clôture…
17 – Action préventive (8.5.3)
- Objectif: éliminer les causes de non-conformité potentielles (NC)
- Contenu: comparable aux actions correctives

20 commentaires