Publication des Templates Qualitiso : SMQ et documentation pour les fabricants de dispositifs médicaux
Après 2 ans de travail c’est le jour J, Qualitiso met à votre disposition un système de templates pour vos activités règlementaires et normatives, accessible par abonnement.
Ces documents constituent une nouvelle proposition, entre les textes applicables et votre propre documentation, conçus pour vous accompagner dans la mise en oeuvre d’un système qualité et la création de la documentation technique de vos dispositifs médicaux.
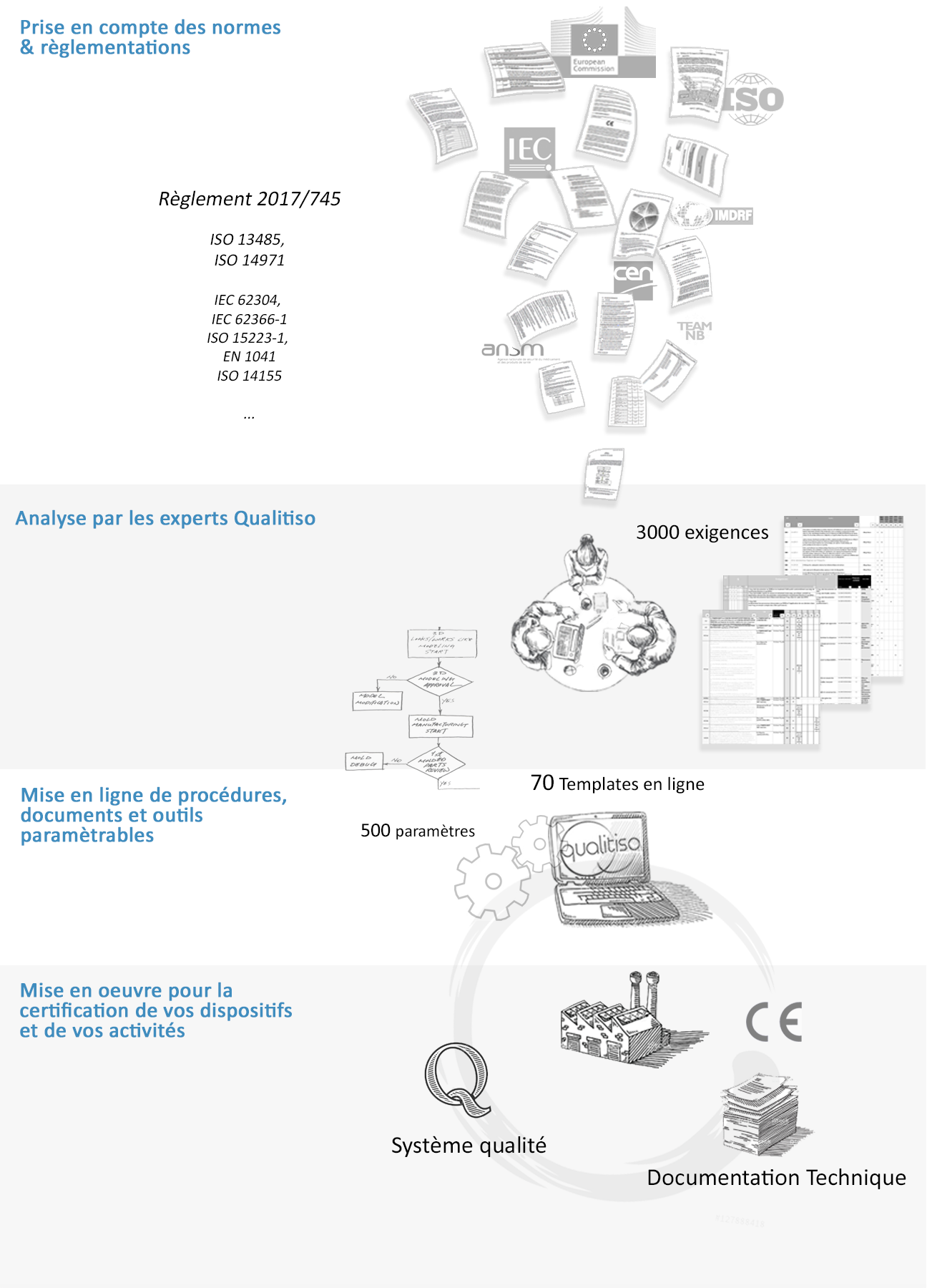
Les Templates Qualitiso tiennent compte du nouveau Règlement (UE) 2017/745 relatif aux dispositifs médicaux – applicable dès mai 2020 dont nous vivons en ce moment la période de transition – ainsi que des principales normes du secteur.
Cet article présente le système de Templates Qualitiso, son fonctionnement et son utilisation.
Une nouvelle offre pour accompagner les acteurs du dispositif médical
L’objectif est clair : vous faire gagnez en temps et en efficacité pour traiter les exigences règlementaires du secteur.
Que ce soit au travers des articles de blog sur Qualitiso, durant les accompagnements ou via des formations il est toujours question d’apporter une information, une explication et une méthode pour répondre à vos besoins.
Les templates et outils Qualitiso partagent la même finalité, en bénéficiant d’une disponibilité totale et d’un savoir wikipédien.
Et parce que les changements règlementaires et normatifs n’ont jamais été aussi nombreux et complexes les documents sont améliorés en permanence, grâce à vos retours et au travail des experts Qualitiso.
Répondre à l’ensemble des exigences des principales normes et règlementations
Les documents et outils sont construits pour fournir une réponse à chacune des exigences applicables, plus de 3’000 exigences sont couvertes par les Templates Qualitiso :
| Référentiel | Titre | Nombre d’exigences |
|---|---|---|
| Règlement (UE) 2017/745 | Règlement relatif aux dispositifs médicaux | 1’300 exigences applicables aux fabricants |
| ISO 13485 | Dispositifs médicaux – Systèmes de management de la qualité – Exigences à des fins réglementaires | 400 exigences |
| ISO 14971 | Dispositifs médicaux – Application de la gestion des risques aux dispositifs médicaux | 100 exigences |
| IEC 62366-1 | Ingénierie de l’aptitude à l’utilisation (IAU) appliquée aux dispositifs médicaux | 50 exigences |
| IEC 62304+A1 | Logiciels de dispositifs médicaux – Processus du cycle de vie du logiciel | 200 exigences |
| IEC 60601-1+A1 | Appareils électromédicaux – Partie 1 : exigences générales pour la sécurité de base et les performances essentielles | 400 points |
| EN 1041+A1 | Informations fournies par le fabricant de dispositifs médicaux | 40 exigences |
| ISO 15223-1 | Dispositifs médicaux – Symboles à utiliser avec les étiquettes, l’étiquetage et les informations à fournir relatifs aux dispositifs médicaux – Partie 1 : exigences générales | 40 symboles |
Des exigences issues d’autres référentiels sont, le cas échéant, également implémentées : directive 93/42/CEE, Règlement 207/2012 ou encore ISO 7000.
Notez que le guide ISO TR 20416 relatif à la surveillance après commercialisation (en cours de rédaction) est également utilisé. De manière générale les travaux en cours sur les normes sont intégrés aux templates dès que possible.
Un accompagnement pour votre aventure règlementaire
Accompagner vos activités
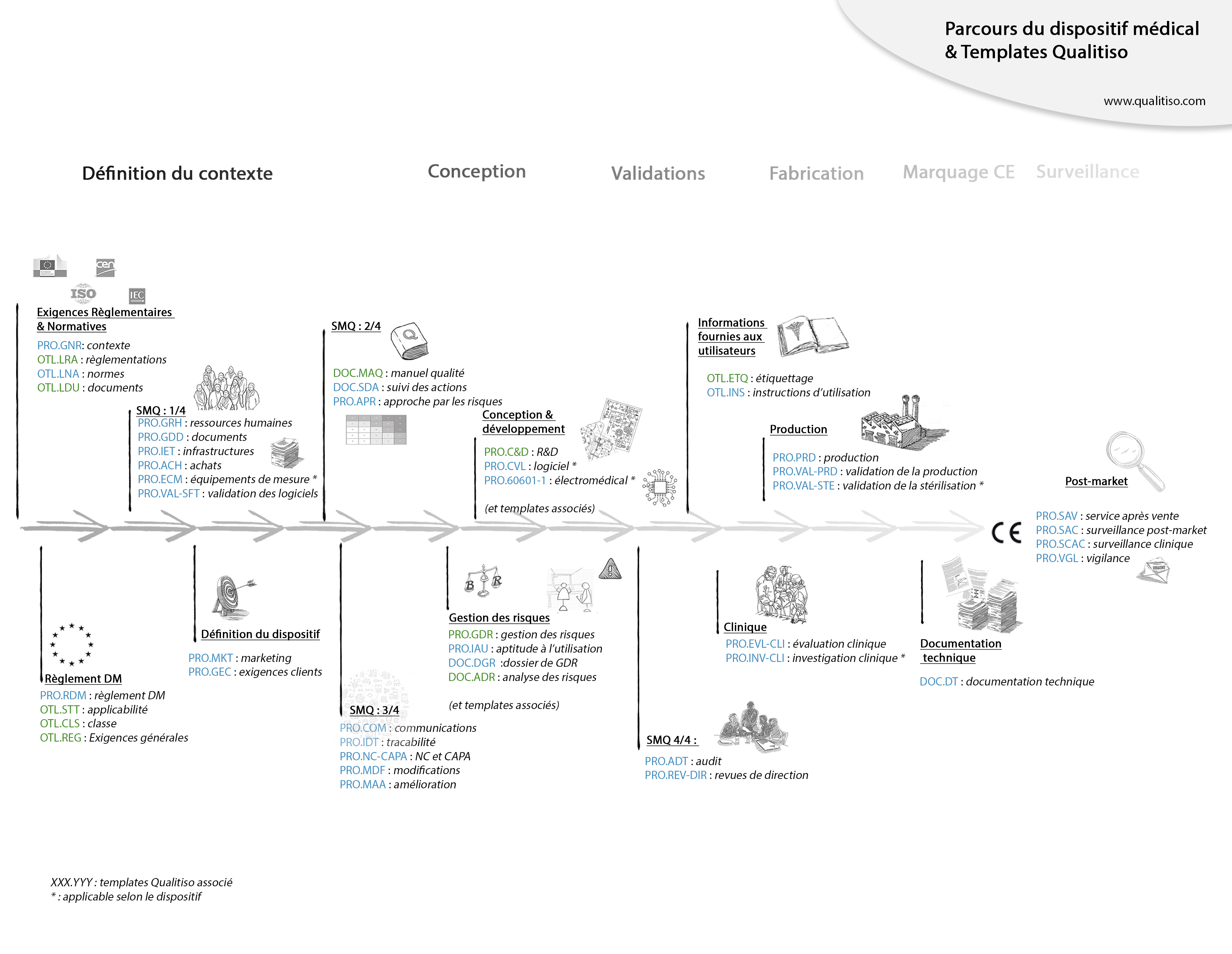
De l’idée de dispositif jusqu’à sa mise sur le marché les Templates Qualitiso vous accompagnent pour créer votre système qualité et gérer la documentation technique de votre projet.
Cette aventure prendra classiquement de 9 mois à 2 ans selon la complexité de votre dispositif et de votre système, mais les étapes sont toujours les mêmes :
- Définir et prendre en compte le contexte règlementaire et normatif
- Construire – progressivement – un Système de Management de la Qualité
- Concevoir et développer le dispositif
- Vérifier et valider le développement
- Construire la documentation technique du DM
- Obtenir le marquage CE
- Mettre sur le marché
- Et enfin : assurer la surveillance après commercialisation
Tout ceci est résumé ci-dessous et mis en perspective avec l’utilisation des Templates Qualitiso. :
S’adapter à votre contexte
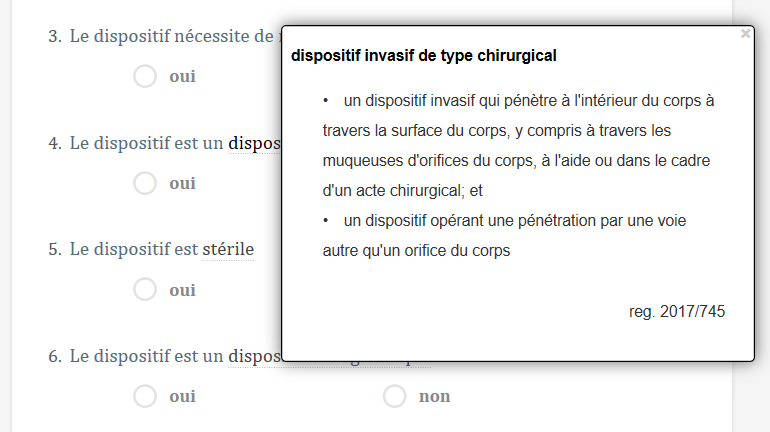
Les Templates Qualitiso sont paramétrables, plus de 500 points sont analysés sur la base de centaines d’informations qui vous seront demandées au fil de l’utilisation du système.
Les réglages sont simplissimes et consistent à répondre par oui ou non, sinon à cocher une case.
Plus de 500 définitions contextuelles viennent vous accompagner lors des réglages, en vous évitant de partir en quête de la définition perdue.
Et des astuces pratiques
L’interface est pensée pour vous, des fonctions d’impression et d’importation vous permettent de consulter et d’exploiter les documents hors ligne.
Bonne nouvelle : l’interface explique les décisions du logiciel, vous êtes en effet en présence d’une I.A. (une Intelligence Artisanale) qui se veut boite blanche, vous pourrez prendre connaissance des informations écartées par le système et connaitre les justifications des exigences applicables.
Un travail collégial
Les documents sont maintenus par les experts Qualitiso, des expériences et des activités professionnelles qui font de cette équipe de spécialistes du DM une source d’information niveau seconde étoile de champion du monde :
- Cyrile Michaud, “M. Logiciel”, co-gérant de M101 Consulting
- Anne Laure Bailly, experte clinique multi fonctions et co-gérante de TechMD
- Souheil Mansour expert en sécurité électrique et dispositif électromédicaux, responsable des essais sur les dispositifs médicaux pour SGS CTS
- Johann Bonami expert SMQ et stérilisation, gérant de HerMediqual et auditeur pour un organisme notifié le soir et le week-end
- Frédéric Bouchardie expert validation logiciels et procédés, gérant de Inspir Action Consulting,
Auditeurs, acteurs de la normalisation, consultants, … autant d’expériences et de connaissances pour créer un système adapté à tous.