Apple Watch Series 4 et contexte dispositif médical

Avec la sortie de l’Apple Watch Series 4 la marque à la pomme créé l’événement en lançant son premier dispositif médical.
Apple étant un fabuleux faiseur de tendance il est intéressant d’analyser la portée de son aventure médicale et de la transposer au contexte Européen.
Résumé des revendications médicales
Les revendications sont extraites du communiqué d’Apple en écartant ce qui n’est pas relatif au médical.
Apple Watch Series 4… help users manage their health… revolutionary health capabilities,… new ECG app, which has been granted a De Novo classification by the FDA… , becomes an intelligent guardian for your health… receive a heart rhythm classification… can classify if the heart is beating in a normal pattern or whether there are signs of Atrial Fibrillation (AFib), a heart condition that could lead to major health complications.
Ainsi, le dispositif a pour finalité de réaliser une classification du rythme cardiaque : normal ou pathologique (détection d’une fibrillation auriculaire). Notez la notion de “complications majeures pour la santé”, nous verrons que cela a un impact très important en Europe.
L’utilisation revendiquée correspond bien à la définition de dispositif médical, avec des finalités en rapport avec le diagnostic d’une maladie, l’investigation sur un état pathologique et l’investigation sur un processus physiologique.
Dernière information : c’est uniquement le logiciel qui a le statut de DM, pas la montre ni son capteur, une bizarrerie rendue possible une FDA très soucieuse de ne pas freiner le secteur de la santé mobile :

Courrier de la FDA
La FDA est l’autorité états-unienne en matière des dispositifs médicaux, elle vient de communiquer une lettre à Apple où elle confirme la classification de l’application ECG en classe II.
Rapide explication de la procédure US (je ne suis pas expert, n’hésitez pas à corriger) :
Pour mettre sur le marché un dispositif médical, un fabricant a deux options :
- Faire un “Dossier 510k” : une mise sur le marché rapide par comparaison avec un “predicate device” : un dispositif plus ou moins similaire déjà sur le marché qui va servir de référent pour établir la sécurité et l’efficacité du nouveau dispositif.
- Faire un “Dossier de-novo” : dans le cas où aucun dispositif référant n’est disponible, les modalités dépendent alors de la classe du nouveau dispositif.
Avec son innovation Apple tombe dans le De-Novo, la classe II permet une mise sur le marché avec une PMN (une simple notification au près de la FDA) là où une classe III aurait demandé une PMA (une approbation de la FDA).
Nous sommes donc à une étape où Apple vient d’avoir confirmation de la classe, l’appli ECG peut être mise sur le marché à condition de mettre en œuvre des process qualité (surveillance, gestion, des documents, gestion des informations fournies à l’utilisateur, …) et de construire les dossiers réglementaires pour le dispositif, en tenant compte d’exigences générales et particulières (du fait de la classe II).
La FDA est ensuite susceptible de mener une inspection à Cupertino, c’est donc une mise sur le marché avec contrôle ultérieur.
Liste des contre-indications
Vu le document de la FDA, l’application ECG est :
Une révolution- Destinée à détecter une arythmie type fibrillation auriculaire (0.1 cas nouveau / 100 par an avant 40 ans)
- Destinée aux utilisateurs de 22 ans est plus (surtout les plus : les nouveaux cas sont multipliés par 20 à 80 ans)
- À utiliser uniquement à titre informatif, sans interprétation ou prise de décision clinique
- Non destiné au diagnostic
Et en Europe ?
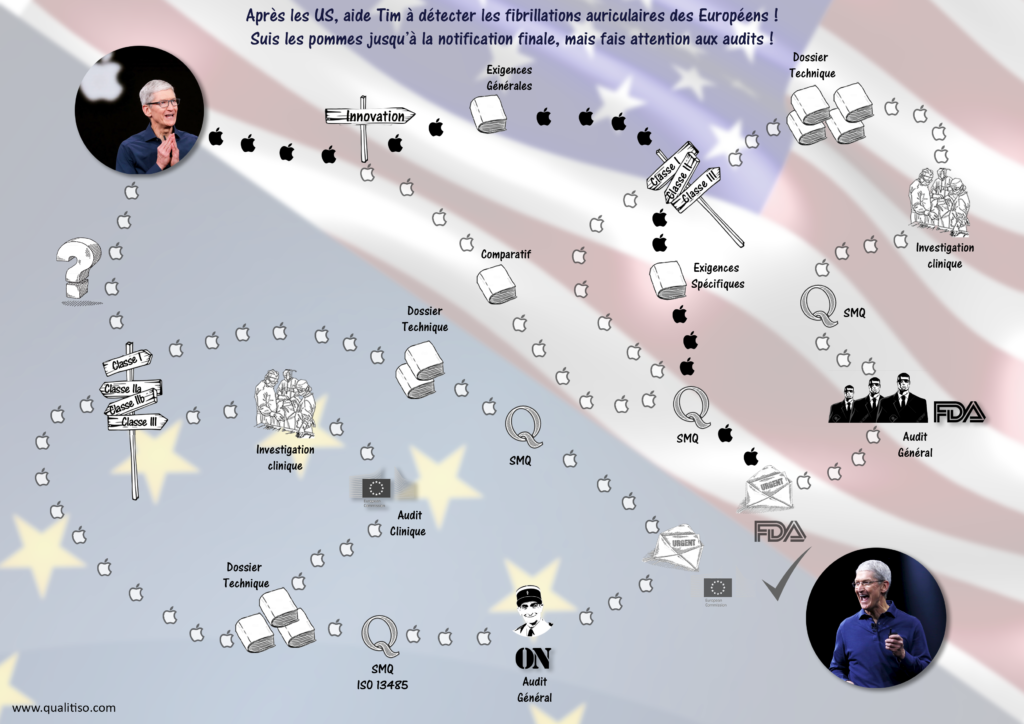
La revendication est encore floue mais devrait être associée à du diagnostic ou à de l’investigation.
Point dur : j’imagine mal comment ne pas certifier le hardware : c’est en effet lui qui fait la mesure. Sinon l’appli pourrait (devrait) utiliser un bracelet ECG certifié médical plutôt qu’une smartwatch grand public, mais la version Hermès est plutôt élégante.
Classe de dangerosité
Une précision : la règlementation UE est à cheval entre la directive 93/42/CEE et le règlement (UE) 2017/745 applicable en mai 2020 mais déjà mis en oeuvre pour les nouveaux projets.
Ainsi :
- Sous la directive l’appli tombe en classe IIa ou IIb, en fonction du blabla relatifs aux “major health complications” :
Règle 10 : Les dispositifs actifs destinés au diagnostic font partie de la classe IIa s’ils sont destinés à permettre un diagnostic ou un contrôle direct des processus physiologiques vitaux.
Sauf s’ils sont spécifiquement destinés à surveiller les paramètres physiologiques vitaux, lorsque des variations de certains de ces paramètres, notamment ceux des fonctions cardiaques, peuvent présenter un danger immédiat pour la vie du patient, auquel cas ils font partie de la classe IIb.
- Sous le règlement c’est IIa, IIb ou III, et même classe I si l’on abandonne tout ce qui est diagnostic, décision thérapeutique et contrôle de processus physiologique.
Les logiciels destinés à fournir des informations utilisées pour prendre des décisions à des fins thérapeutiques ou diagnostiques relèvent de la classe IIa, sauf si ces décisions ont une incidence susceptible de causer:
– la mort ou une détérioration irréversible de l’état de santé d’une personne, auxquels cas ils relèvent de la classe III, ou
– une grave détérioration de l’état de santé d’une personne ou une intervention chirurgicale, auxquels cas ils relèvent de la classe IIb.Les logiciels destinés à contrôler des processus physiologiques relèvent de la classe IIa, sauf s’ils sont destinés à contrôler des paramètres physiologiques vitaux, lorsque des variations de certains de ces paramètres peuvent présenter un danger immédiat pour la vie du patient, auxquels cas ils relèvent de la classe IIb.
Tous les autres logiciels relèvent de la classe I.
Et le grand écart est immense entre une classe I en auto-certification et une classe III où une investigation clinique devra être menée avec l’aval d’un comité d’experts européen.
Notez l’obligation dès la classe IIa de recourir à un organisme notifié pour approuver les activités d’Apple, une grosse étape pour cette petite start-up freinée à tout-va par la règlementation.

2 commentaires