Quelles données seront publiques sur Eudamed ?
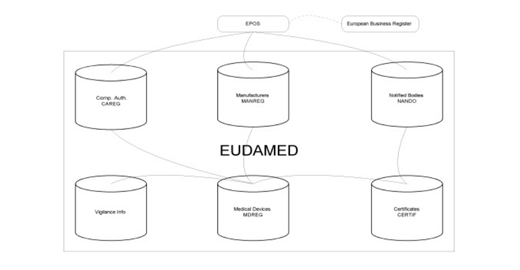
La commission européenne a publié la version 4.1 des spécifications techniques d’Eudamed, la base de données introduite par le règlement DM (voir l’article 33).
L’occasion d’identifier les exigences générales sur l’interface d’Eudamed ainsi que les données qui seront accessibles au grand public.
Généralités
Quelques spécifications sur l’interface:
- L’interface utilisateur sera proposée dans toutes les langues de l’UE
- L’interface doit répondre aux canons du web (on l’imagine responsive)
- Proposer un moteur de recherche
- Être user friendly
Et un rappel des finalités :
- Informer le public des dispositifs mis sur le marché et des certificats attribués par des ON
- Permettre l’identification des opérateurs économiques
- Permettre un accès aux données publiques déposées par les fabricants
Informations sur les opérateurs économiques
Les opérateurs regroupent les fabricants, distributeurs, mandataires, importateurs.
Les investigateurs sont également concernés.
Toutes les données d’identification seront disponibles, seules les informations confidentielles ne seront pas affichées, cette notion reste à éclaircir mais regroupe vraisemblablement les données personnelles, les données commerciales, les informations sur les investigations cliniques échangées entre les États membres et la Commission).
Certificats et Organismes Notifiés
- Liste des organismes notifiés
- Liens vers la base NANDO, qui contient le scope des notifications (en fonction de codes de dispositifs)
- Liste des certificats accordés par les organismes notifiés
- Liste des certificats refusés par les ON
- Informations sur les certificats délivrés, modifiés, suspendus, amendés …
- Liste des ON par État membre et résumé des audits réalisés par ces États
- Résumé des activités de contrôle des ON par les États membres
- Historique des justifications des ON en cas de non-respect des avis des panels d’experts européens
IUD et MDN
- Liste des IUD-ID de base et informations sur les dispositifs associés
- Pouvoir faire des exports des résultats de recherche dans la base IUD, incluant les données sur les DM associés à l’IUD
- Pouvoir faire des recherches dans la nomenclature européenne des dispositifs médicaux (MDN)
Informations techniques sur les dispositifs
- Résumé des performances cliniques et de sécurité
Investigations cliniques
- Liste des investigations cliniques dans l’UE
- Liste des applications et notifications
- Mise à jour des essais
- Résumé de l’investigation
- Rapport d’investigation
- Lien vers des informations complémentaires (notamment de sécurité)
- Liste des événements de vigilance et informations associées
Vigilance (par les fabricants)
- Informations de surveillance et de vigilance appropriées (elles ne sont pas encore déterminées)
- Recherche dans la base de FSN (uniquement les fiche finales)
- Visualisation du contenu des FSN
Surveillance (par les États membres)
- Base de résumés des résultats des examens et des évaluations des activités de surveillance du marché d’un État membre
- Possibilité de télécharger ces résumés
