Gadgétisation de la santé: Médical vs Bien-être

Après avoir défini les branches de la santé connectée et expliqué la réglementation applicable, fin du cycle sur la esanté avec un billet d’humeur, qui regarde la “gadgétisation de la santé”, ou quand des dispositifs de santé / de bien-être flirtent avec les dispositifs médicaux (DM).
L’idée est de cerner la différence entre DM et gadget de santé, comprendre le point de vue des fabricants et observer les réaction des autorités (l’Europe et la FDA).
[get-tech-sante]
DM vs Gadget: les définitions
Dispositif médical
En Europe, la définition de dispositif médical est donnée par la directive 93/42/CE, de natures diverses les DM sont caractérisés par leur finalité. La définition est assez longue, elle est résumée dans ce visuel:
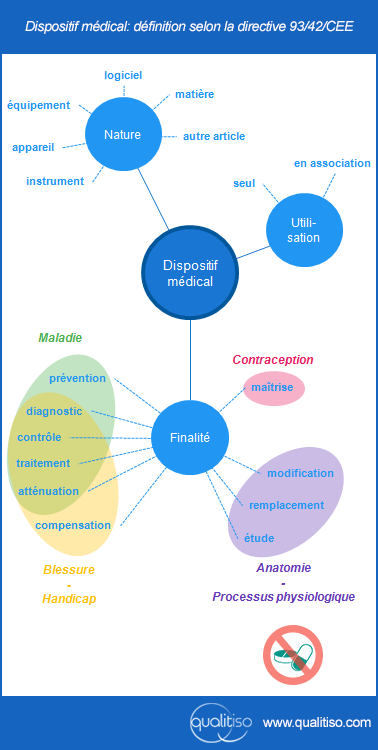
Cette finalité est définie par le fabricant, comme précisé dans la directive:
” (…) destiné par le fabricant à être utilisé chez l’homme à des fins (…) “
Ainsi, rien n’empêche de sortir un produit d’apparence médicale mais destiné par le fabricant à des fins de divertissement. G.E. peut très bien commercialiser une IRM de salon pour égayer vos longues soirées d’hivers. Dans ce cas la mise sur le marché se fait après vérification de la conformité à deux trois directives et autres textes réglementaires à portée générale, on tombe dans la catégorie “appareils electrodoméstiques”, celle de votre machine à laver ou de votre Playstation.
Gadget
Selon le CNRTL:
“Petit objet qui plaît plus par sa nouveauté et son originalité que par son utilité.“
La certification médicale: c’est long, c’est cher, mais à quoi ça sert ?
Réponse courte
À ne pas creuser le trou de la sécu. avec des dispositifs tout pourris.
Réponse longue
À avoir des garanties sur la qualité des dispositifs utilisés à des fins médicales.
Un dispositif médical doit répondre à une série d’exigences essentielles, en les respectant le fabricant apporte plusieurs garanties:
- Un dispositif utilisable en toute sécurité: via des tests en laboratoire portant notamment sur la sécurité électrique et la compatibilité électromagnétique (histoire que le pace maker de papy ne bugge pas à chaque SMS reçu sur son portable); mais aussi des documents d’accompagnement et un étiquetage pertinents, une vérification de l’aptitude à l’utilisation, une maîtrise des risques menée durant toute la vie du produit,…
- Des performances cliniques démontrées par une évaluation clinique ou à minima par une revue de la littérature.
- Des performances techniques vérifiées, validées et répétables, ce qui peut passer par une assurance de la qualité des activités de conception, fabrication, contrôle final,…
- Un suivi du produit après sa mise sur le marché via une surveillance “post market”, avec des mesures adaptées en cas de défaillance sur le terrain, qui passent par une communication avec les autorités compétentes (l’ANSM en France).
En plus des exigences essentielles le fabricant doit respecter des procédures de vérification de la conformité, ces procédures sont dimensionnées en fonction de la classe du dispositif médical, classe directement liée à la dangerosité potentielle du produit.
Dans bon nombre de cas (tous les cas sauf la classe I) la mise sur le marché nécessite l’intervention d’un organisme notifié, qui va approuver tout ou partie des activités du fabricants.
Tout ceci est long (des années) cher (des dizaines de k€, voir plus) mais absolument nécessaire vu le contexte.
Bah.. pourquoi mon tensiomètre connecté n’est pas conforme aux exigences médicales ?
Je reviens sur la définition de DM: “destiné par le fabricant“.
Le fabricant de votre capteur d’oxymètrie pour smartphone, balance connectée(*), lecteur de glycémie pour iPad [rayer la mention inutile] a précisé dans les conditions générales d’utilisation que son produit ne doit pas être utilisé à des fins de diagnostic / de contrôle d’une maladie, seulement à des fins récréatives. Et il a le droit. Et vous avez le droit de l’acheter.
Cela ne veut pas dire que ces dispositifs sont mauvais (ils utilisent très souvent des solutions OEM également employées par les fabricants de DM) mais certains peuvent être imprécis, buggés, voir dangereux, on ne sait pas: malgré les tests très certainement effectués par le fabricant il n’y pas eu de recours à tous les processus, éprouvés, en place dans le médical.
Mais il faut être honnête: chercher à s’y retrouver dans la réglementation est un vrai parcours du combattant, je comprends que des industriels se sentent perdus lorsqu’ils s’attaquent à la santé, mais plus d’excuses, [auto-promo] vous trouverez plein d’infos utiles sur ce blog [/auto-promo].
(*) au passage, les balances utilisées à des fins médicales sont soumises à la métrologie légale, avec la petite vignette verte qui va bien.
Flou artistique et réaction des autorités
La directive 93/42 présuppose la bonne volonté des industriels. Mais certains ne se revendiquent pas comme fabricants de DM tout en entretenant le flou auprès des patients clients.
Cela rappelle le temps où l’industrie agroalimentaire se la jouait industrie du médicament, en promettant amour gloire et beauté après digestion de leur marchandise, avant de se faire rappeler à l’ordre par les autorités compétentes.
De nos jours la situation se répète avec les dispositifs de santé, en réaction l’Europe y va de son livre vert sur la mHealth (voir ce résumé), l’Ordre National des Médecin y va de son livre blanc sur la santé connecté et le consommateur n’hésite pas à faire chauffer sa carte bleu en espérant une santé plus rose [vous m’excuserez, je suis en plein apprentissage du coloriage avec ma fille].
La FDA, qui sait se faire prendre au sérieux: aux états unis les autorités de santé tiennent plus du flic que du bureaucrate Européen, expose les choses sans ambiguïté: gare au fabricant qui revendique une utilisation médicale pour son dispositif “de bien être”.
Ce draft de la FDA propose des exemples d’applications “de bien-être” : suivi du poids (hors suivi de maladie), relaxation, amélioration du QI, suivi de l’alimentation.. et d’applications médicales: diagnostic d’une obésité, traitement de l’anxiété, diagnostic de l’autisme, traitement des troubles alimentaires.
Voir également le guide de la FDA pour les applications mobiles médicales.
Des contre-exemples
Des produits de e-santé / m-santé sont de véritables dispositifs médicaux, des exemples:
- Un ECG pour iPhone
- Un stéthoscope à brancher sur le port casque d’un smartphone
- Un moniteur de glycémie pour iPhone (décidément, les pommes sont bonnes pour la santé)
- Un dispositif de quantified self pour suivre la maladie de Parkinson
- Un dispositif de contrôle ophtalmique pour smartphone (avec un soft et de l’optique)
- Un moniteur de pression artérielle, toujours pour smartphones
Ce qui prouve que l’on peut sortir des DM, exploitant les technologies modernes, tout en séduisant les utilisateurs.

2 commentaires