FAQ : Dispositions transitoires pour les produits en annexe XVI
Certains dispositifs sans finalité médicale sont néanmoins soumis au règlement (UE) 2017/745 relatif aux dispositifs médicaux ; ils sont listés en annexe XVI.
Le règlement d’exécution (UE) 2022/2346 modifié par le règlement d’exécution (UE) 2023/1194 définit des spécifications communes pour les produits en annexe XVI (dispositions transitoires et exigences en matière de gestion des risques).
Une FAQ publiée par la commission européenne reprend les modalités de la période de transition.
Depuis le 22 décembre 2022 pour les produits déjà CE selon la directive 93/42/CEE, depuis le 22 juin 2023 pour les autres produits.
Depuis le 22 juin 2023.
Voir les spécifications commune, leur amendement, le règlement (et ses amendements) article 120.3
Les conditions et dates échéances sont résumées ci-dessous :
cas de produits sans certificat directive 93/42 délivré par un ON :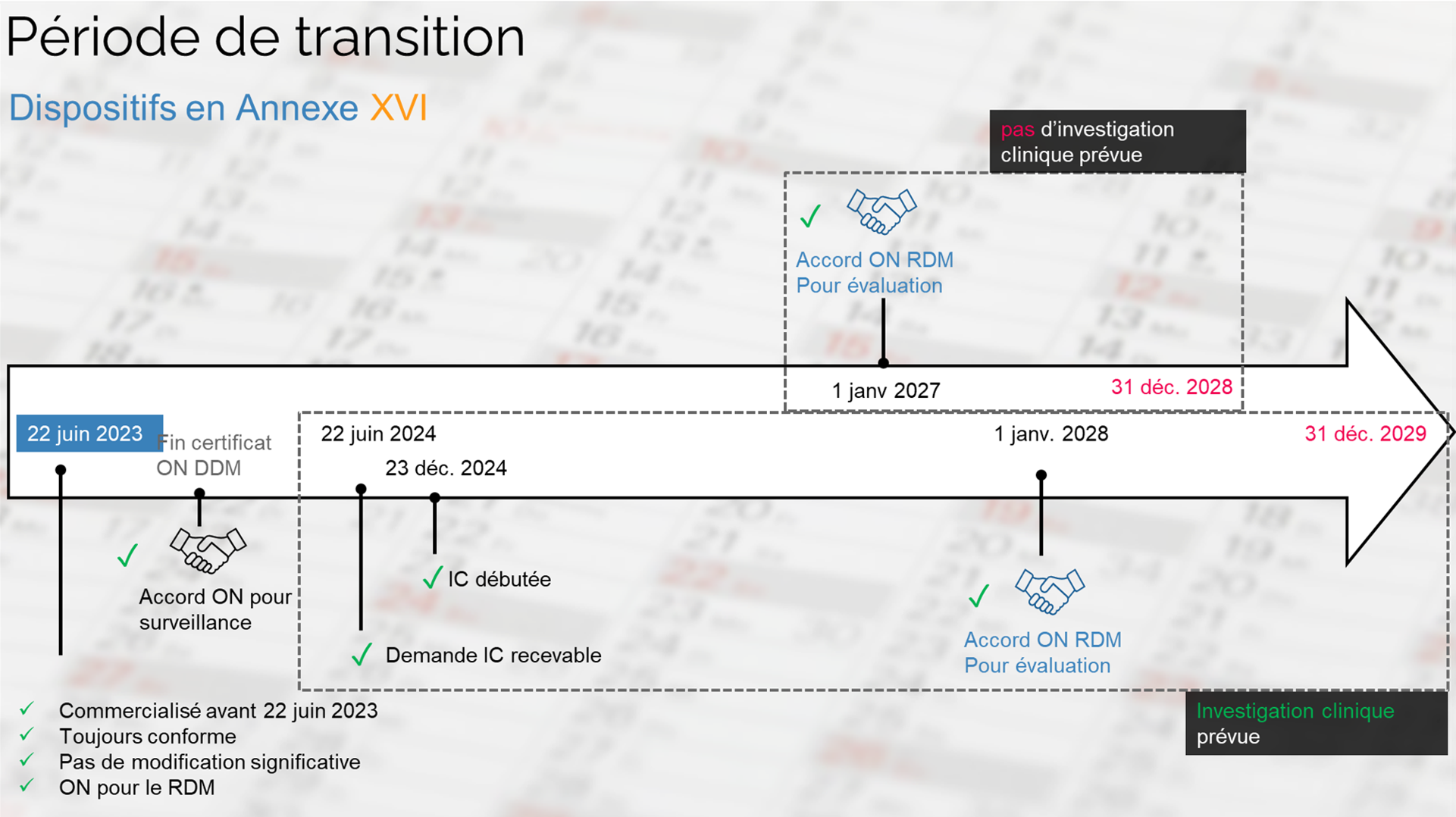
cas des produits certifiés 93/42 via un organisme notifié :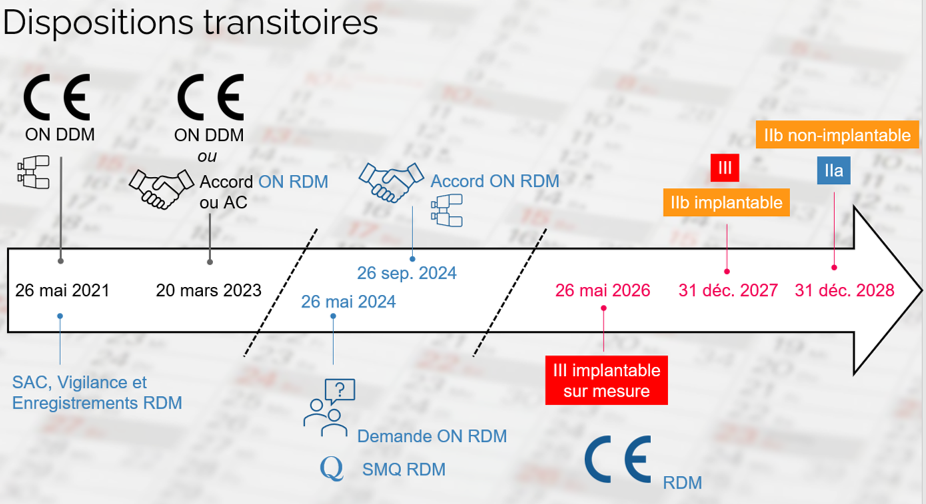
Pas de mesure spéciale, voir les conditions pour les DM classe III si le médicament est utilisé en action secondaire, voir avec l’EMA sinon.
Choisir les dispositions transitoires les plus contraignantes parmi celles pour les DM et celles pour les produits en annexe XVI.
En faisant une auto-déclaration en attendant la lettre de confirmation (de la demande d’évaluation) de l’organisme notifié pour le RDM
Non, pas de date limite, les produits mis sur le marché durant la période de transition peuvent être mis à disposition pendant et après la période transitoire applicable.
Oui, depuis le 23 juin 2023.
