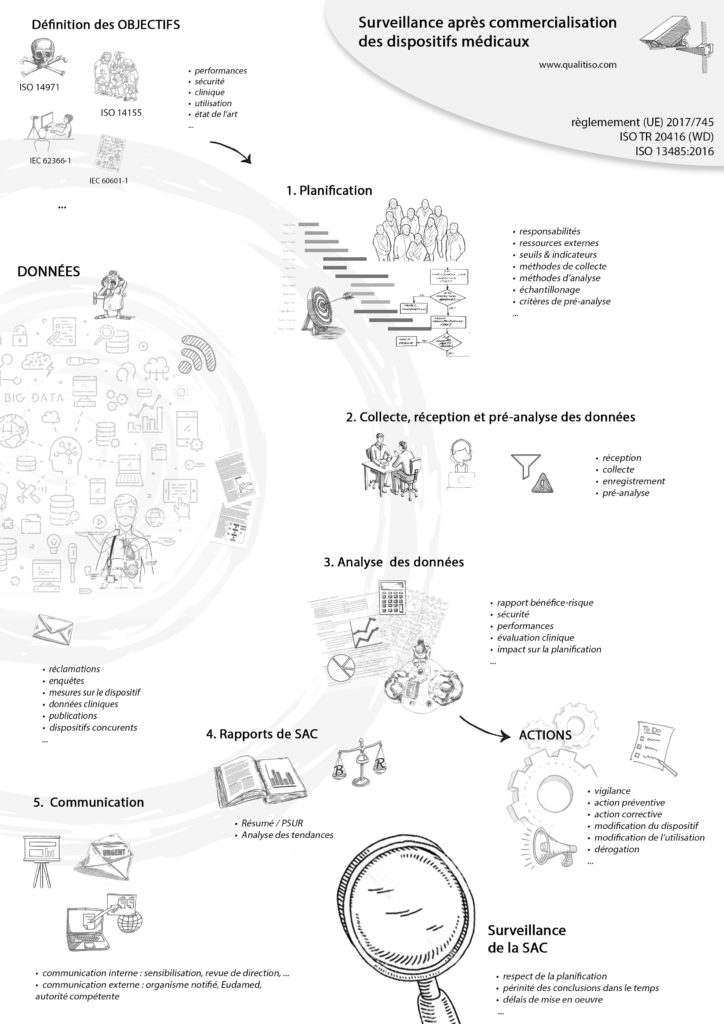
ISO/TR 20416 : Surveillance après commercialisation • Résumé du guide
Le guide ISO/TR 20146:2020 “Dispositifs médicaux – Surveillance post-commercialisation pour les fabricants” a été publié en juillet dernier, l’occasion de résumer le contenu de ce guide.
Vous retrouverez ces principes, et au delà, dans les templates relatifs à la SAC.
Voir également l’article consacré à la SAC selon le règlement.
Champ d’application
Faire un processus de SAC, selon les normes ISO 13485 et ISO 14971.
Références normatives
- ISO 13485:2016, et son § “mesures, analyse et amélioration”
- ISO 14971, et son § “activités de post production”
Définitions
Rien d’utile, les termes sont déjà définis dans la règlementation, et les définitions réglementaire prennent le dessus sur les définitions normatives
Objectifs de la SAC
Du très général :
- surveiller la sécurité et les performances des dispositifs
- répondre aux exigences réglementaires
- alimenter le cycle de vie du DM (mise à jour de la gestion des risques, des données cliniques…)
Planification
Du très classique :
- Faire un plan de SAC
- Définir le dispositif, ses conditions d’utilisations, sa durée de vie…
- Définir responsabilités et autorités
- Définir des objectifs
- Définir les moyens et méthode de collecte et d’analyse des données
- Faire des revues
Définir les objectifs
Le guide vous invite à vous poser des questions très bateau pour trouver un sens à votre SAC :
- Un nouveau danger ou une nouvelle situation dangereuse ont-ils été identifiés pour le dispositif médical ou des dispositifs médicaux similaires ?
- Y a-t-il une utilisation abusive, intentionnelle ou non, du dispositif médical ?
- Le dispositif médical répond-il aux besoins de l’utilisateur après une utilisation clinique à moyen/long terme ?
- Y a-t-il des effets secondaires imprévus pour le dispositif médical ou des dispositifs médicaux similaires ?
- L’utilisation prévue pourrait-elle être étendue à une nouvelle population de patients ?
- Quels facteurs environnementaux pourraient provoquer un “événement indésirable A” après “X” années d’utilisation de dispositifs médicaux ?
- L’état de l’art a-t-il changé après la conception et le développement du dispositif médical ?
- L’âge moyen du patient, au moment de l’implantation du dispositif médical, a-t-il une incidence sur la durée de vie du dispositif médical ?
- La formation des utilisateurs/patients peut-elle réduire la probabilité de dysfonctionnement ?
- Le dysfonctionnement du dispositif médical a-t-il un impact sur l’analyse risques-avantages ?
- Le dispositif médical présente-t-il un nouveau danger ?
- Les indications ou contre-indications étaient-elles appropriées pour garantir la sécurité et l’efficacité de l’utilisation prévue du dispositif médical ?
- Les utilisateurs ont-ils rencontré des problèmes de convivialité ?
- Les dysfonctionnements récurrents sont-ils dus à des insuffisances de service ou d’entretien ?
- Est-il possible d’identifier des tendances significatives à la hausse ou à la baisse pour un dysfonctionnement spécifique d’un dispositif médical représentant une source possible de dommage ?
- Le risque de “blessure X” est-il corrélé à l’emplacement anatomique du dispositif médical ou à l’âge du patient ?
- Quel est le taux de survie à long terme du dispositif médical ?
- Comment le traitement affecte-t-il la qualité de vie du patient ?
Notez que si vos autres processus sont au point, vous avez déjà identifié toutes ces questions, ainsi que les indicateurs pour y répondre.
Collecte des données
Deux approches à combiner :
- Proactive : enquêtes, recherche documentaire, études cliniques…
- Réactive : examen des non-conformités, examen des incidents…
Évidement, il faudra planifier les moyens, les besoins humains et matériel, la période… pour collecter les données
Rapport
Sans surprise, il fait le lien entre les données de SAC et votre documentation, en précisant l’impact des nouvelles données sur vos conclusions, particulièrement en matière de sécurité et de performance
Méthodes d’analyse
Je vous invite à consulter l’article sur l’analyse graphique en SAC.
Résumé et plus
Source : ISO