Stratégie pour le règlement (UE) 2017/745
Depuis la publication du règlement (UE) 2017/745 et de son second correctif, les possibilités pour les fabricants en matière de stratégie règlementaire sont multiples, elles dépendent de la date, de la classe des dispositifs selon le règlement et la directive 93/42/CEE mais aussi de la disponibilité des organismes notifiés.
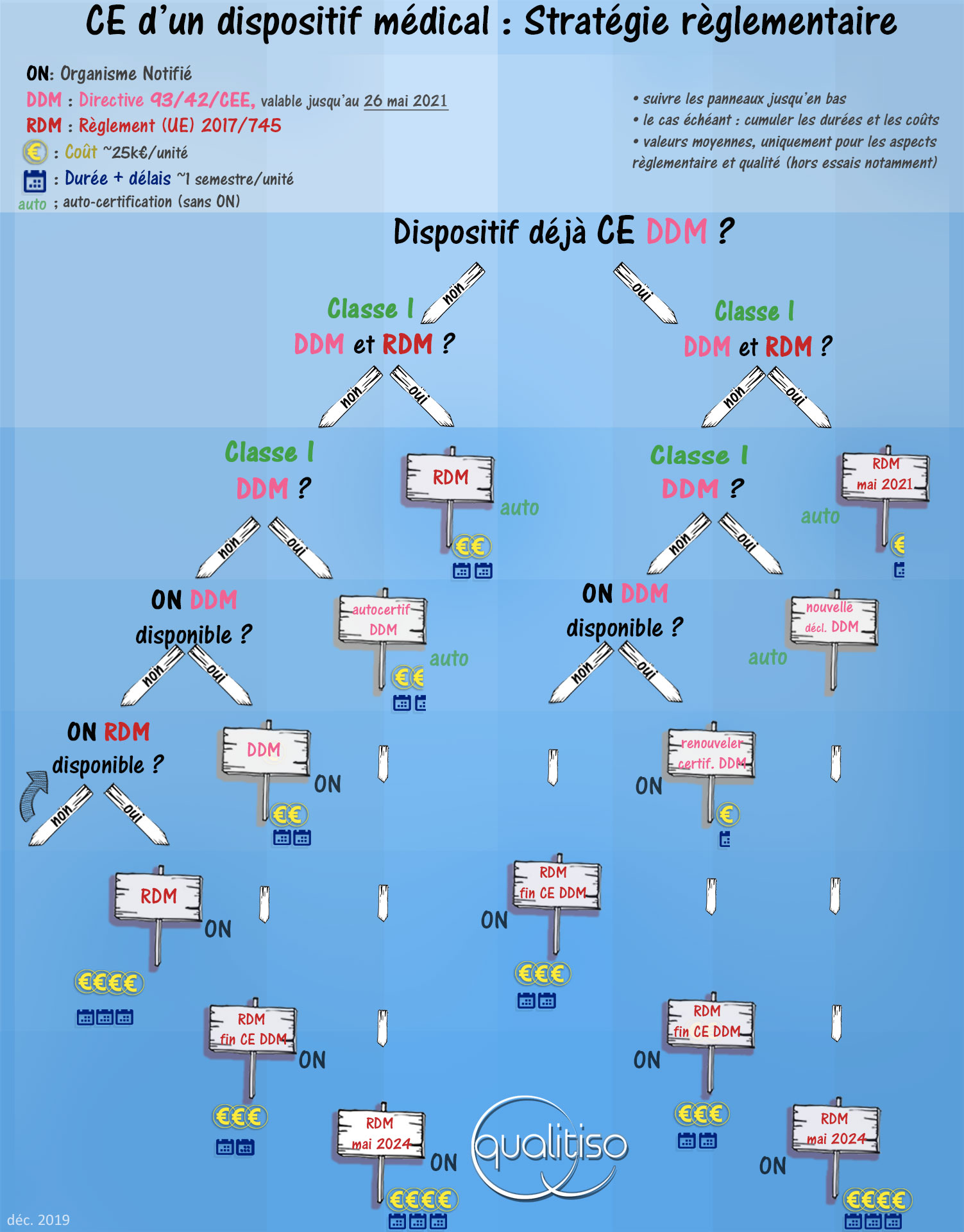
Le schéma ci-dessous montre les cas possibles, un outil en ligne vous propose une stratégie règlementaire en quelques clics.
Les indications en termes de durées et de coûts sont données à titre indicatif, en fonction de l’ambition de votre projet vous pouvez multiplier ces chiffres par 2 ou 3.
Notez que les coûts et les durées sont purement règlementaires, sans tenir compte des autres postes, tels que les essais en laboratoire ou les investigations cliniques.
À retenir
- Les dispositifs de classe I dans la directive et le règlement sont les premiers à obligatoirement devoir adopter le RDM.
- Les possibilités en matière de directive 93/42/CEE sont valables jusqu’au 26 mai 2021.
- En cas de recours à un ON : il y a tout intérêt à repousser la certification RDM, en renouvelant les certificats ou – si possible – en obtenant un premier certificat selon la directive.
- Les dispositifs médicaux de classe I sous la directive et changeant de classe sous le règlement ont tout intérêt à être certifiés, sans recours à un ON, selon la directive.
- À compter du 26 mai 2021 tous les nouveaux dispositifs devront être conformes au règlement.
- Les ON ne proposent quasiment plus de certification selon la directive
- Très peu d’ON sont actuellement certifiés pour le règlement : 9 en décembre 2019, 12 attendus début 2020, 20 avant le règlement… sachant qu’il en faudrait une cinquantaine.
- Les certifications selon le règlement sont globalement de 50% à 100% plus chères que les certifications selon la directive.

5 commentaires