Faire une Veille Réglementaire

Assurer une veille réglementaire est une obligation pour des secteurs réglementés, comme le dispositif médical ou la pharmacie, où « nul n’est censé ignorer la loi » (bien que cela relève de la fiction juridique).
La veille réglementaire est souvent confiée au responsable des affaires réglementaire et/ou au responsable qualité, elle vise à surveiller des sources d’informations préalablement sélectionnées et à détecter les nouveautés.
Cet article présente des principes et techniques afin de réaliser une veille réglementaire, il propose des exemples applicables au secteur du dispositif médical.
La veille réglementaire consiste à surveiller un environnement réglementaire, pour en identifier les changements et s’y adapter.
Pour garantir la conformité des produits et services aux exigences réglementaires, particulièrement lorsque des autorisations ou certifications doivent être accordées.
Une personne doit être désignée en interne comme responsable de la veille, le plus souvent le responsable qualité / réglementaire. La veille peut être sous-traitée en partie ou en totalité à des prestataires externes.
La veille réglementaire repose le plus souvent sur un mélange de :
1. Veille manuelle (consultation des sources)
2. Veille automatisée (remontée automatique des informations)
3. Veille sous-traitée (réception d’un résumé périodique)
Qu’est-ce que la veille réglementaire et pourquoi la faire ?
Par définition la veille réglementaire consiste à surveiller l’environnement réglementaire, pour identifier les nouveautés, analyser leur applicabilité, analyser l’impact et planifier des actions.
En fonction de la complexité et des ressources la veille est réalisée en interne, ou sous-traitée.
Comment réaliser une veille ?
Les étapes lors des activités de veille sont résumées ci-dessous :
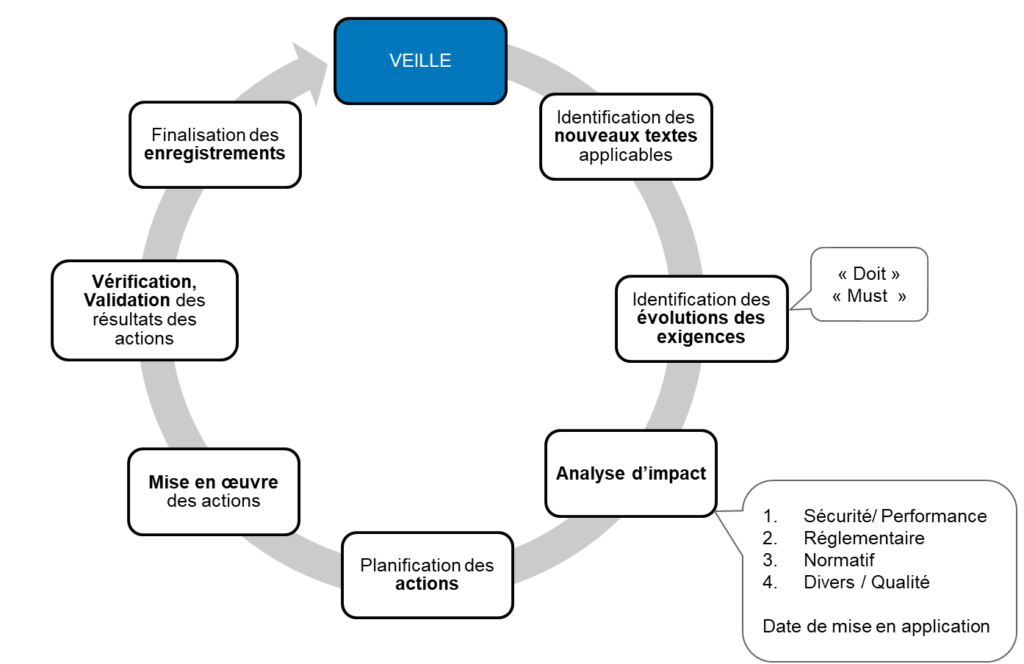
Les activités de veille réglementaire
- Planifier la veille
Définir les sources d’informations, les supports d’information, responsabilités, moyens, ainsi que les périodes de surveillance et les enregistrements associés.
- Réaliser la veille
Faire appel à des moyens manuels, automatiques et/ou externes
- Identifier les changements applicables
L’objectif est d’identifier les exigences nouvelles ou modifiées et d’évaluer leur applicabilité.
- Analyser l’impact
Évaluer l’impact des évolutions selon une approche par les risques, qui justifiera le niveau des actions décidées.
En contexte dispositifs médicaux, on utilise souvent 4 niveaux de risques :
1. Patient : impact sur la sécurité et/ou sur les performances des dispositifs.
2. Réglementaire : impact sur la conformité réglementaire des produits et/ou des activités, sans impact pour le patient.
3. Normatif : impact sur la conformité par rapport à une norme, sans conséquence pour le patient et la conformité réglementaire.
4. Autre. - Mettre en œuvre les nouveautés
– Planifier des actions et les mettre en œuvre.
– Vérifier et valider le résultat des actions.
– Enregistrer les données utiles.
Ces activités sortent de la veille et concernent les processus visés (ex : révision d’une norme technique qui impacte la conception).
Veille réglementaire
La réglementation définit les exigences que l’entreprise devra respecter au quotidien, dans un environnement réglementaire très dense.

Les zones réglementaires
En contexte Européen on surveillera les publications de la Commission Européenne et celles d’organismes connexes, comme l’EMA.
À l’international chaque zone a sa propre réglementation : FDA, Santé Canada ou encore la TGA dans le secteur du médical seront à surveiller en fonction des marchés visés.
Les réglementations nationales
Notez que les Nations gardent la main sur une partie de leur réglementation, particulièrement en matière de santé. Aussi en Europe les États peuvent modifier des directives / compléter des règlements .
On surveillera les informations des autorités compétentes où sont commercialisés les prduits : ansm, swiss medic, afmps…
Exemples de sources réglementaires dans le dispositif médical
Veille normative
Les normes contiennent les moyens de répondre aux exigences réglementaires, elles restent majoritairement d’application volontaire.
En Europe, les normes harmonisées font présomption de conformité, elles sont très utilisées et donc à bien surveiller.

Les organismes de normalisation
La normalisation se joue à 3 niveaux :
- International : les comités de normalisation ISO et IEC (électronique) produisent des normes internationales.
- Européen : le CEN et le CENELEC (électronique) produisent des normes EN, reprenant les normes internationales avec des avant-propos et des annexes propres au contexte réglementaire européen. Les normes harmonisées sont gérées et listées par la Commission Européenne.
- National : chaque pays a son propre organisme de normalisation, qui lui-même est membre des organismes Européens et internationaux : BSI, EVS, ILNAS…
Chaque organisme de normalisation possède des (sous-) Comités Techniques qui publient couramment l’état de leurs travaux.
Les types de normes
Tous les textes publiés ne sont pas systématiquement des normes, on trouve des guides d’application, des normes expérimentales… Les textes sont publiés à différents stades, on utilisera à profit les stades “enquête publique” (projets de normes) dont les brouillons quasi définitifs sont accessibles gratuitement.
Finalement, on surveillera les normes harmonisées sur le site de la commission Européenne.
Exemples de sources dans le dispositif médical
- International : ISO TC 210
- Europe : Normes harmonisées
- National : Norminfo
Veille sur internet
Les outils informatiques permettent d’automatiser un processus long et répétitif, il est conseillé de les mettre au service de vos activités !
Les chemins de l’information
On utilise couramment les supports ci-dessous, les avantages et inconvénients sont rapidement listés :
| Support | Avantages | Inconvénients |
|---|---|---|
| Newsletters | Souvent proposées, exhaustives | Peut inonder et saturer les boites mails |
| Réseaux sociaux | Identifient des informations pertinentes, voire inédites | Les flux sont vite pollués, les infos se perdent, l’accès est parfois restreint ou nécessite la souscription d’un compte, nécessitent des consultations manuelles |
| Flux RSS | Exhaustif, non pollué | Pas toujours proposé, non rémanent |
| Surveillance des pages (mix) | Sur mesure | Doit être conçu (et validé) en interne |
Mettre en œuvre une surveillance automatique sur-mesure
La surveillance automatique de pages peut vous faire gagner un temps considérable, tout en garantissant l’exhaustivité de la veille, à supposer que vous ayez identifié les sources pertinentes et validé vos outils (dans le cadre de la validation des logiciels du SMQ).
Le plus simple est de fusionner plusieurs flux rss, c’est possible via de simples navigateurs web ou des services et applications dédié, qui embarquent des fonctions de filtrage, de recherche, de classement…
Dans la mesure où les flux rss ne sont pas systématiquement proposés sur les sites, on aura recours à des outils de génération de flux, comme Wachete qui peut également vous avertir par mail.
Finalement, un moyen simple et flexible consiste à utiliser un tableur, type Google Sheets. Des fonctions natives permettent de récupérer des contenus variés (rss, xml, html, csv… et même json via des scripts), d’autres fonctions permettent de manipuler les données et ainsi faciliter la consultation.
Quelques exemples de fonctions Google Sheets pour importer des données :
- IMPORTHTML : retourne un tableau ou une liste dans une page web
- IMPORTDATA : récupère un fichier csv (type tableur)
- IMPORTXML, IMPORTRANGE …
Autres exemples de fonctions, pour manipuler des données : FILTER, SORT, SUBSTITUTE, RECHERCHE, CONCATENER …
Exemples de veille via Google Sheets
Import du flux RSS d’actualité de l’UE dans le secteur DM :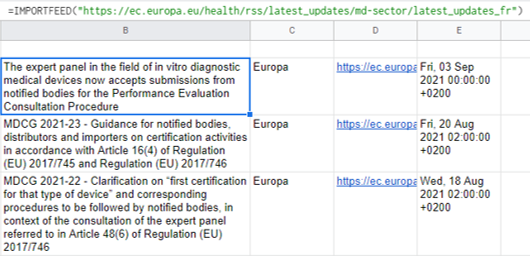
Import du tableau HTML des publications du comité ISO/TC 150 :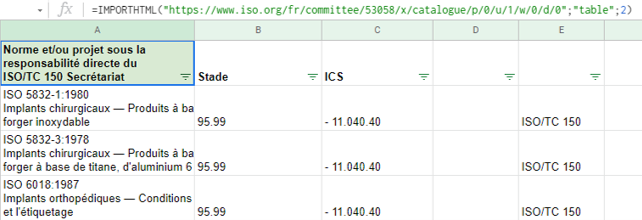
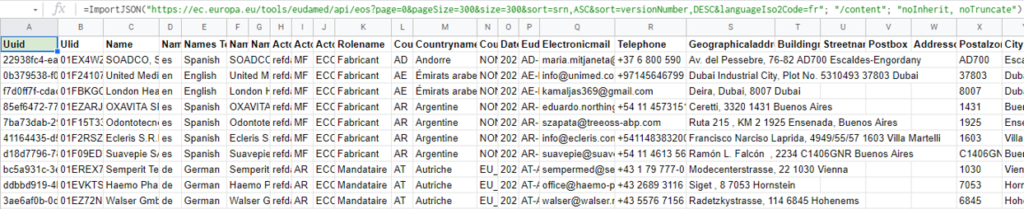
Import du fichier JSON des opérateurs économiques enregistrés dans Eudamed :