NF EN ISO 14971:2013 et annexes Z
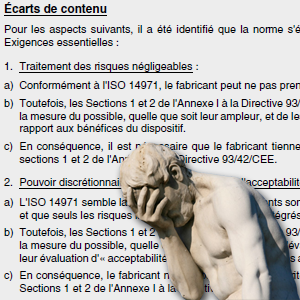
La norme ISO 14971 concerne l’application de la gestion des risques aux dispositifs médicaux (DM), la version Française a récemment connu un second tirage, apportant de légères modifications aux annexes Z.
L’occasion de présenter le contenu de ces annexes et de voir en détail les modifications apportées à l’annexe ZA, annexe mettant en relation l’ISO 14971 et les exigences essentielles de la directive 93/42/CEE relative aux DM.
Un nouveau tirage pour des modifications mineures
Précisons tout d’abord la notion de (re)tirage: il s’agit de modifications mineures de la norme: correction orthographique ou changement de tournure de phrase.
Un nouveau tirage est piloté par un organisme national : l’AFNOR dans le cas de la NF EN ISO 14971 (voir l’article sur les abréviations des titres de normes: la NF est la version Française de la EN ISO, la EN ISO est la version Européenne de la norme ISO, les exigences des 3 versions étant strictement identiques).
Les modifications apportées par le second tirage ne portent que sur les annexes Z.
Des annexes Z relatives aux directives Européennes
Une annexe Z est un ajout propre à la version EN d’une norme, de telles normes sont des normes harmonisées à des directives Européennes, les annexes Z mettent en regard les exigences d’une directive et les moyens de mise en conformité fournis par la norme.
Dans le cas de l’ EN ISO 14971 se sont 3 directives qui sont visées, les relations sont données dans 3 annexes:
- Annexe ZA pour la directive 93/42/CEE relative aux dispositifs médicaux (DM)
- Annexe ZB pour la directive 90/385/CEE relative aux dispositifs médicaux implantables actifs (DMIA)
- Annexe ZC pour la directive 98/79/CE relative aux dispositifs médicaux de diagnostic in vitro (DM-DIV)
Remarques: les notions de DM, DMIA et DM-DIV sont détaillées dans l’article sur les différentes familles de DM.
L’ISO 14971:2007 en est à sa 4ième version Française
Revenons sur l’historique des normes issues de l’ISO 14971:2007:
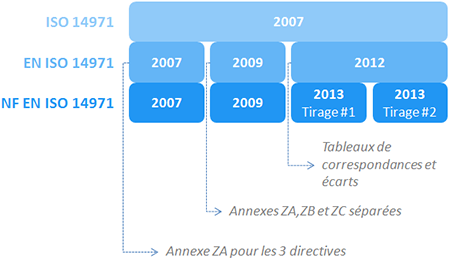
En 2007: une nouvelle révision de la norme est publiée: ISO14971:2007. La même année les versions Européennes et Françaises sont également proposées, ces versions contiennent une unique annexe ZA, très succincte, précisant que la norme est harmonisée vis à vis des exigences des directives DM, DMIA et DM-DIV.
En 2009: l’annexe ZA est divisée en 3 annexes, une par directive, avec un contenu toujours aussi laconique. Cette modification de la version EN est retranscrite dans la version FR, les deux textes passent en version 2009.
En 2012: les annexes Z sont étoffées de tableaux de correspondance entre les exigences des directives et les articles de la norme. 5 ans après avoir harmonisé la norme l’Europe se rend compte qu’il y a des écarts avec les exigences de la directives, ces divergences sont formalisées, la version EN passe en version 2012, la FR en version 2013 (le temps de coller le logo de l’AFNOR).
En 2015: un nouveau tirage de la version FR est publié, la version reste en 2013.
L’annexe ZA ne fait pas l’unanimité
N’étant pas spécialiste des autres directives, je me concentre ici sur l’annexe ZA concernant la 93/42/CEE.
L’annexe ZA comporte deux grandes parties:
- Tableau de correspondance entre les articles de la norme et les exigences essentielles de la directive: les exigences 1, 2, 4 ,5 ,6 et 7.1 sont partiellement couvertes par l’ISO 14971.
- Un résumé des écarts significatifs entre les exigences Européennes et la norme.
Notez qu’un lien entre la norme et les procédures de marquage CE des DM est également donné (en résumé: le dossier de gestion des risques contient les résultats de l’analyse des risques attendu par la directive, l’article 9 “informations de production et de postproduction” permet de répondre aux exigences réglementaires en matière de suivi après mise sur le marché).
Une annexe ZA de plus en plus contraignante
Dans l’EN ISO 14971:2012 7 écarts de contenu avaient été mis en évidence.
Ainsi, contrairement aux exigences de la norme et conformément à celles de la directive:
- Les risques négligeables doivent tout de même être pris en compte.
- L’acceptabilité des risques peut ne pas être évaluée avant réduction.
- Le concept de réduction des risques aussi faible que raisonnablement praticable (AFQRP) peut ne pas être appliqué pour des considérations d’ordre économique.
- Le rapport bénéfice risque doit être analysé pour chaque risque ainsi que pour le risque global.
- Le fabricant peut être amené à cumuler les mesures de maîtrise des risques prévues (sécurité inhérente par conception + mesure de protection sur le DM ou intégrée au processus de fabrication + information pour la sécurité).
- La 1ière mesure de maîtrise des risque devient “éliminer ou réduire autant que possible les risques (sécurité inhérente à la conception et à la fabrication)” le texte avant la parenthèse étant propre à la directive.
- Le fabricant ne doit pas réduire de risque en s’appuyant sur les informations fournies à l’utilisateur.
Avec le second tirage de 2015 les points 2 et 3 ne sont plus optionnels:
- L’acceptabilité des risques ne doit pas être évaluée avant réduction (c.a.d. : TOUS les risques doivent être réduits).
- Le concept de réduction des risques AFQRP ne doit pas être appliqué pour des considérations d’ordre économique (c.a.d. : réduisez les risques quitte à rendre le dispositif hors de prix).
En résumé: alors que la norme ISO 14971 laisse place à une mise en œuvre disons .. raisonnée, la version EN est beaucoup plus systématique : chaque risque (même négligeable) doit être réduit, et ce autant que possible, sans tenir compte du coût, sans s’appuyer sur les informations fournies aux utilisateurs et le rapport bénéfice risque doit être systématiquement évalué.
Une annexe à oublier ?
En 2012 les fabricants étaient affolés par l’évolution de la norme, oublier le facteur économique est impensable, ne pas tenir compte des informations fournies à l’utilisateur est en opposition avec les bonnes pratiques, maîtriser des risques négligeables n’est pas forcément la priorité d’un industriel… Dans la pratique les habitudes n’ont guère évolué.
L’association d’organisme notifié team-nb a publié un document sur l’interprétation et la mise en œuvre des annexes Z, ci dessous un résumé des recommandations pour la prise en compte des 7 écarts:
- Il faut identifier et estimer tous les risques mais la maîtrise n’est pas généralisée.
- Seuls les risques pouvant provoquer la mort ou une détérioration sérieuse de l’état de santé sont à réduire.
- Le facteur économique n’est pas à écarter, mais il ne doit pas prendre le dessus sur l’aspect sécurité.
- L’analyse du rapport bénéfice risque est à utiliser pour évaluer l’acceptabilité des risques non acceptables après maîtrise.
- La réduction des risques s’achève dès que le risque est acceptable.
- En première intention il faut tacher de réduire un risque en jouant sur la conception et la fabrication.
- Une information sur ce que l’utilisateur doit faire ou ne pas faire pour éviter une situation dangereuse est considéré comme une mesure de réduction du risque
En définitive l’avis de team-nb balaye l’annexe ZA, cette vision très critique est confirmée en fin de document:
Comme il a été démontré, les Annexes Z de l’EN ISO 14971:2012 contiennent des erreurs et des phrases parfois déroutantes.

3 commentaires