Qualitiso • Le site des Dispositifs Médicaux
Bienvenue sur Qualitiso
Article au hasard
Contenu par sujets
Veille, normes et documents
Sélection d’articles
Templates
Forum
Réglement (ue) 2017/745
Sélection d’articles
Templates
Vidéos
Système de Management de la Qualité
Sélection d’articles
Templates
- 📄 Document • Manuel Qualité
- 📄 Document • Suivi des NC, CAPA
- 📄 Document • Suivi Des Actions
- 📅 Plan • Conception et Développement
- ▶️ Procédure • Approche par les Risques
- ▶️ Procédure • Audits
- ▶️ Procédure • Conception et Développement
- ▶️ Procédure • Gestion des Achats
- ▶️ Procédure • Gestion des Documents
- ▶️ Procédure • Gestion des Équipements
- ▶️ Procédure • Gestion des Exigences des Clients
- ▶️ Procédure • Gestion des Modifications
- ▶️ Procédure • Gestion des Ressources Humaines
- ▶️ Procédure • Identification et Traçabilité
- ▶️ Procédure • Infrastructures et Environnement de Travail
- ▶️ Procédure • Marketing et contact commercial
- ▶️ Procédure • Mesures, Analyse et Amélioration
- ▶️ Procédure • Non-Conformités et CAPA
- ▶️ Procédure • Production et Prestations de service
- ▶️ Procédure • Revue de Direction
- ▶️ Procédure • Service Après-Vente
- ▶️ Procédure • Validation de la Production
- ▶️ Procédure • Validation des Logiciels du SMQ
- 🔎 Revues • Conception et Développement
- ❎ Spécification • Exigences sur le Dispositif
Forum
Documentation Technique et Informations fournies
Sélection d’articles
Templates
Gestion des Risques et Aptitude à l’Utilisation
Sélection d’articles
- Introduction à la norme ISO 14971
- L’ISO 14971 à l’heure du règlement
- Le dossier de gestion des risques
- Guide pour construire une analyse des risques
- Identification des risques des DM
- Estimations et suivi des probabilités
- Résumé de la norme XP S99-223
- Visualisation des données pour l’analyse B/R
- Résumé de la norme IEC 62366-1
- Exemples d’erreurs d’IAU
Templates
- ▶️ Procédure • Gestion des Risques
- ▶️ Procédure • Analyse des Risques et du rapport B/R
- 📄 Document • Analyse des risques
- ▶️ Procédure • Ingénierie de l’Aptitude à l’Utilisation
- 📓 Dossier • Gestion des Risques
- 📅 Plan • Gestion des Risques
- 📅 Plan • Ingénierie de l’Aptitude à l’Utilisation
- 📓 Rapport • Évaluations d’IAU
- 🔎 Revues • Gestion des Risques
- 🔎 Revues • Ingénierie de l’Aptitude à l’Utilisation
Logiciel et Électronique
Sélection d’articles
- Logiciels médicaux et Règlement DM
- Résumé de la norme IEC 62304
- Cybersécurité des dispositifs médicaux
- Résumé de la norme IEC 82304-1
- Marquage CE d’un dispositif électro-médical
- Les classes, types et groupes de D-EM
- Résumé de la norme IEC 60601-1
- Résumé de la norme IEC 60601-1-11
- Mémo : Les alarmes des dispositifs médicaux
Templates
- ▶️ Procédure • Cycle de Vie du Logiciel
- ▶️ Procédure • Gestion de la Cybersécurité
- ▶️ Procédure • gestion de la Sécurité Électrique
- ❎ Exigences • Essais selon la norme 60601-1
- ❎ Spécification • Architecture Logicielle
- ❎ Spécification • Exigences Logiciel
- ❎ Spécification • Fichier de Configuration du Logiciel
- ❎ Spécification • Unités Logicielles
- 📅 Plan • Développement du Logiciel
- 📅 Plan • Test du Logiciel
- 📓 Rapport • Test du Logiciel
- 🔎 Revues • Gestion du Cycle de Vie du Logiciel
Evaluations Biologiques et Cliniques
Sélection d’articles
Templates
Post-Market
Sélection d’articles
Templates
- ▶️ Procédure • Suivi Clinique Après Commercialisation
- 🗃️ Codes IMDRF des Effets indésirables
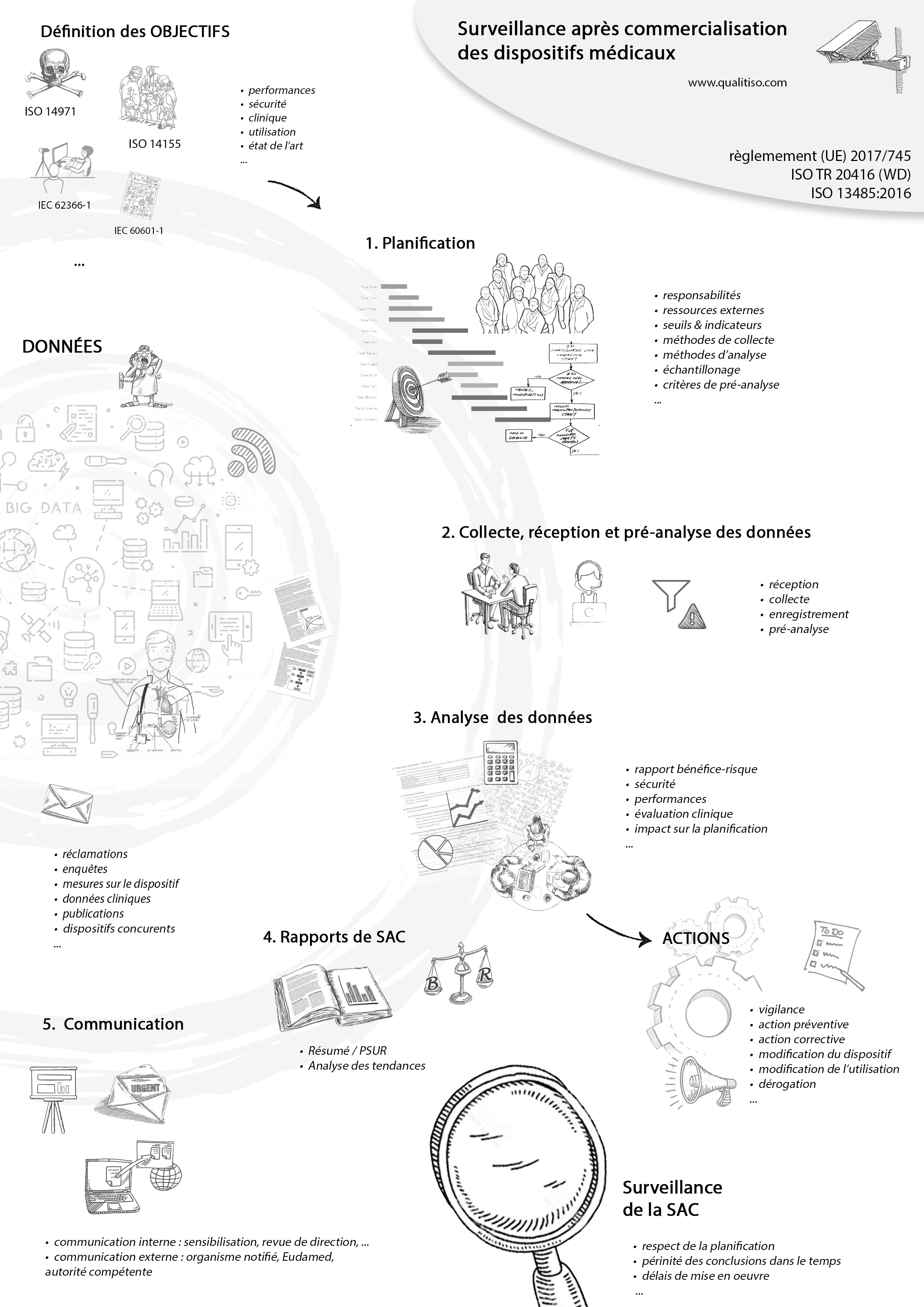
- ▶️ Procédure • Surveillance Après Commercialisation
- ▶️ Procédure • Vigilance
- 📅 Plan • Suivi Clinique Après Commercialisation
- 📅 Plan • Surveillance Après Commercialisation
- 📓 Rapport • Periodic Safety Update Report
- 📓 Rapport • Suivi Clinique Après Commercialisation
- 📓 Rapport • Surveillance Après Commercialisation
Autres sujets
Sélection d’articles
- Généralités sur la notion de Risque
- Covid-19 • Analyse et suivi dans le temps
- L’IA utilisée pour le médical
- L’impression 3D utilisée pour le médical
- Considérations environnementales les DM
- Les règlementations environnementales applicables
- Les normes pour le management environnemental
- Les principaux risques dans le monde
- Risques associés au changement climatique
- Un monde en 2100
Activité récente
accueil accueil
- [QualitiBot v1.1] Gestion de la mémoire long terme par Projetson 10 Mar. 2026 at 11 h 34 min
Nouvelle capacité pour le bot : Mémorisation des informations communiquées et générées, pour construire vos Projets sur le long terme.
- Décret relatif à la normalisation en France, mise à jour 2026on 18 Fév. 2026 at 10 h 14 min
Mise à jour des dispositions françaises vis-à-vis de la normalisation.
- Présentation de QualitiBot – L’assistant IA spécialisé dispositifs médicaux (UE)on 17 Fév. 2026 at 9 h 10 min
Découvrez QualitiBot, assistant IA spécialisé Dispositifs Médicaux.
- Mise à jour des normes harmonisées au RDMon 9 Fév. 2026 at 6 h 20 min
Mise à jour des normes harmonisées pour le MDR
- Évaluation Clinique : La norme ISO 18969 est en enquête publiqueon 20 Jan. 2026 at 14 h 46 min
La norme ISO 18969 pour l'évaluation clinique des dispositifs médicaux est en enquête publique, retrouvez un résumé de ses exigences.
- MDCG 2025-7 Rev. 1 : le calendrier du Master UDI-DI pour l’optiqueon 22 Déc. 2025 at 12 h 16 min
MDCG 2025-7 Rev. 1 : articulation entre étiquetage UDI, enregistrement EUDAMED et déploiement du Master UDI-DI pour les dispositifs optiques hautement individualisés.
- Joyeux Noël !on 20 Déc. 2025 at 13 h 46 min
- MDCG 2025-10 & PMS : de la théorie MDR au plan « audit-proof »on 20 Déc. 2025 at 7 h 05 min
Résumé du guide MDCG 2025-10 relatif à la PMS (surveillance après commercialisation).
- Fermeture du forum Qualitiso au 1er janvier 2026on 19 Déc. 2025 at 7 h 50 min
Bonjour à toutes et à tous, Le forum sera fermé à compter du 1er janvier 2026. Notez que l\'historique des discussions restera accessible. Ce choix s\'impose face au double impact des modèles de langage (LLMs) : […]
- Proposition de modification du MDR (UE) 2017/745 : Analyse des changements proposéson 18 Déc. 2025 at 14 h 51 min
Projet de révision majeure du RDM: analyse des changements prévus.
- MDCG 2025-9 : Dispositifs Innovants (BtX) – Accélérer l’Accès aux Patientson 16 Déc. 2025 at 8 h 40 min
Résumé du MDCG 2025-9 sur les Dispositifs Innovants "de rupture" (BtX)
- consultation : Dispositifs médicaux — Application uniforme des exigences relatives aux organismes notifiéson 15 Déc. 2025 at 13 h 57 min
Dispositifs médicaux — Application uniforme des exigences relatives aux organismes notifiés […]
- Qualitibot : Premier jalon technique et accès libre jusqu'au 31/12on 5 Déc. 2025 at 8 h 22 min
Bonjour à toutes et à tous, Après une année de développement, QualitiBot franchit un premier jalon. L\'implémentation des compétences fondamentales est désormais (presque) stabilisée ; elle constitue le socle […]
- La Transition MDR/IVDR en 2025 : Une Course Contre la Montre ?on 28 Nov. 2025 at 10 h 04 min
L’enquête de la Commission européenne (28 novembre 2025) dessine un tableau contrasté : la transition vers le MDR et l’IVDR avance, mais à un rythme.
- Décision (UE) 2025/2371 – Les 4 premiers modules d’EUDAMED obligatoires dès le 28 mai 2026on 27 Nov. 2025 at 16 h 13 min
Quatre modules d'EUDAMED sont pleinement opérationnels. À partir du 28 mai 2026, leur utilisation devient obligatoire.
- Étiquette numérique pour représentant autorisé et importateuron 5 Nov. 2025 at 10 h 16 min
MedTech Europe, l\'AESGP , le COCIR et Euromcontact ont demandés à la Commission européenne et aux colégislateurs d\'autoriser, dans un premier temps, la fourniture des informations relatives à […]
- l’évaluation des technologies de la santé, les règles de procédure applicables à l’interaction au cours des évaluations cliniques...on 3 Nov. 2025 at 22 h 22 min
2025/2086 RÈGLEMENT D’EXÉCUTION (UE) 2025/2086 DE LA COMMISSION du 17 octobre 2025 établissant, conformément au règlement (UE) 2021/2282 concernant l’évaluation des technologies de la santé, les règles de […]
- Notification par un État membre d’une décision d’interdiction de mise sur le marché d’un dispositif médical – Dispositif...on 24 Oct. 2025 at 18 h 54 min
Arrêt du Tribunal (huitième chambre) du 12 février 2025. Christoph Klein contre Commission européenne. Santé publique – Cadre réglementaire de l’Union régissant les dispositifs médicaux – Clause de […]
- IA Act et dispositifs médicaux : GMED clarifie les enjeuxon 23 Oct. 2025 at 21 h 58 min
IA Act et dispositifs médicaux : GMED clarifie les enjeux https://lne-gmed.com/fr/newsletters-fr/ai-act-et-dm
- Transférer votre Demande RDM ? Le Guide Pratique du Team-NB pour les Fabricantson 22 Oct. 2025 at 10 h 40 min
Les échéances de transition RDM approchent à grands pas : 31 décembre 2027 pour les dispositifs de classe IIa et IIb, 31 décembre 2028 pour.
- RÈGLEMENT (UE) 2025/40 DU PARLEMENT EUROPÉEN ET DU CONSEIL du 19 décembre 2024 - relatif aux emballages et aux déchets d’emballages,...on 20 Oct. 2025 at 22 h 02 min
Afin de protéger la santé humaine et animale et de préserver la sécurité, en raison de la nature des produits emballés et des exigences correspondantes, les exigences en matière de recyclabilité ne devraient pas […]
- DÉCISION D’EXÉCUTION (UE) 2025/2078 DE LA COMMISSION du 17 octobre 2025 modifiant la décision d’exécution (UE) 2021/1182 en ce qui...on 20 Oct. 2025 at 22 h 01 min
Nouvelle mise à jour des normes harmonisées du Règlement (UE) 2017/745 ! La Commission européenne a publié la décision d’exécution (UE) 2025/2078 du 17 octobre 2025, modifiant la décision (UE) 2021/1182. […]
- Décisions d’Exécution (UE) 2025/681 et 2025/2078 : Mises à jour des normes Harmonisées au MDRon 20 Oct. 2025 at 15 h 11 min
La Commission européenne a publié deux nouvelles décisions d’exécution qui modifient l’annexe de la Décision (UE) 2021/1182. L’objectif ? Actualiser la liste des normes harmonisées.