Veille gratuite
MDCG 2021-12 : FAQ relative à l’EMDN
MDCG 2021-12 : FAQ relative à la nomenclature européenne des dispositifs médicaux
Nouvelle prise en charge transitoire des dispositifs médicaux
La HAS veut faciliter l’accès aux dispositifs médicaux innovants
Marché UE du DM et nouveau règlement : la Turquie suit, la Suisse trinque
Des nouvelles des accords de reconnaissance mutuelle avec la Suisse et la Turquie
26 mai 2021 : des règles plus strictes pour réduire la charge administrative et renforcer la compétitivité, de l’innovation.
Aujourd’hui, de nouvelles règles de l’Union européenne (UE) en matière de dispositifs médicaux entrent en vigueur. Elles permettent la mise en place d’un cadre réglementaire moderne et plus robuste pour protéger la santé publique et la sécurité des patients. La mise en application de ces nouvelles règles avait été reportée d’un an en raison des défis sans précédent posés par la pandémie de Covid-19 : il fallait d’abord que les dispositifs médicaux d’une importance vitale soient mis à disposition le plus largement possible, partout dans l’Union.
ANSM : Demander une autorisation pour une investigation clinique
Formulaires et documents ANSM pour les demande d’investigation clinique selon le règlement (UE) 2017/745
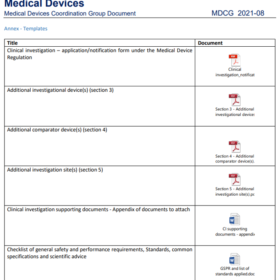
MDCG 2021-8 : Formulaires pour les demandes d’investigation clinique
Guide MDCG 2021-8 et annexes associées pour les formulaires de demande d’investigation clinique
Une brève ISO 21802 du temps
ISO 21802 : Produits d’assistance — Lignes directrices relatives à l’accessibilité cognitive — Gestion du temps quotidien
Guide IMDRF relatif aux études de SCAC
Guide IMDRF relatif aux études PMCF
Règlement DM : la réunion de l’ANSM
Résumé de la réunion d’information ANSM du 18 mai 2021, sur le nouveau règlement DM
Règlements DM : l’analyse de la HPRA
Newsletter de la HPRA dédiée aux nouveaux règlements DM et DM-DIV
Règlements DM : l’analyse de la TGA
Analyse de l’impact des règlements DM en Australie
L’UE propose un helpdesk dédié à l’IUD
Assistance UE aux opérateurs économiques pour la mise en œuvre de l’IUD
ANSM : les liens utiles pour le dispositif médical
Un nouveau site pour l’ANSM, de nouveaux liens à surveiller.
Réussir l’application du règlement Dispositifs Médicaux
Réussir l’application du règlement 2017/745 avec l’afssaps
Mandat pour des normes harmonisées aux règlements DM et DM-DIV
Nouveau mandat pour des normes harmonisées aux règlements (UE) 2017/745 et 2017/746.
COVID-19 : Exonération de droits de douanes et TVA sur le matériel sanitaire
Franchise des droits à l’importation et à l’exonération de la TVA sur les importations octroyées pour les marchandises nécessaires à la lutte contre les effets de la pandémie de COVID‐19
Power point UE relatif au règlement Dispositif Médicaux
Présentation du règlement (UE) 2017/745 par DG Santé
Normes en enquête : dentaire, respi, opthalmo
Les dernières normes en enquête publique
Instructions électroniques pour les DM : enquête pour remplacer le règlement 207/2012
Initiative en enquête publique jusqu’au 25 mai 2021 pour les e-IFU des dispositifs médicaux
Guide MDCG 2021-1 : Eudamed est en retard, on vous dit quoi faire [ MAJ rev 1]
Guide MDCG 2021-1 : mesures vis-à-vis du retard d’Eudamed
EMDN : la nomenclature européenne du DM en consultation
L’EMDN est en consultation publique
MDCG Guidance on Periodic Safety Update Report, draft
Guide MDCG relatif au PSUR et annexes associées
DM Suisse : plan B pour un non-accord avec l’Europe
Mesures prévues en Suisse en cas de non-accord de reconnaissance mutuelle en matière de dispositifs médicaux
Mise à jour du guide MDCG 2018-1 relatif à l’IUD-ID
Quatrième version du guide MDCG 2018-1 relatif à l’IUD-ID
Veille normative via norm’info
Réaliser une veille normative via le site norminfo, particulièrement utile pour le suivi des normes en enquête publique
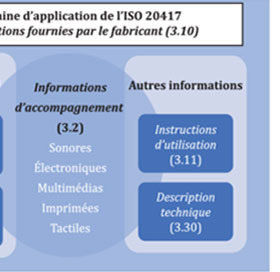
ISO 20417:2021 Dispositifs médicaux — Informations à fournir par le fabricant
Revue de la norme ISO 20417 à l’occasion de sa publication. Contenu et informations utiles en contexte européen.
Guide MDCG 2021-5 : Normalisation Européenne des dispositifs médicaux
Point du MDCG sur la normalisation des dispositifs médicaux.
[chant du cygne] Mise à jour des normes harmonisées à la directive 93/42/CEE
Mise à jour des normes harmonisées à la directive 93/42/CEE, en avril 2021.
Nouvelles normes harmonisées pour les DMIA: évaluation bio, investigation clinique et sté.
Pour son 31e anniversaire : mise à jour des normes harmonisées à la directive 90/385/CEE.
Team NB : rapport 2020
Bilan 2020 du Team NB : une année marquée par rien du tout
Résumé du guide de la TGA sur les preuves cliniques nécessaires aux dispositifs médicaux
Synthèse du – très bon – guide de la TGA sur l’évaluation des données cliniques : Réponses aux exigences générales, Rapport d’évaluation clinique, Documentation Technique, Recours à l’équivalence et Erreurs courantes.
Eurofins Expert Services Oy est notifié pour le règlement 2017/745
20e organisme notifié pour le règlement (UE) 2017/745, bienvenue à Eurofins Expert Services Oy. Retrouvez le champ des notifications dans la nouvelle interface Qualitiso. Source.
Le DM Suisse s’ARM de patience
Évolutions pour les dispositifs médicaux suisses commercialisés en Europe, dans le cadre du nouveau règlement
Démarrage pour les groupes d’experts Européens de l’évaluation clinique.
Lancement des groupes d’experts UE pour les évaluations cliniques des DM
MDCG 2021-3 : FAQ sur les dispositifs sur mesure
FAQ du MDCG relative aux dispositifs médicaux sur mesure
Guides MDCG : Calendrier et Suivi des publications
Suivi et calendrier des publications du MDCG
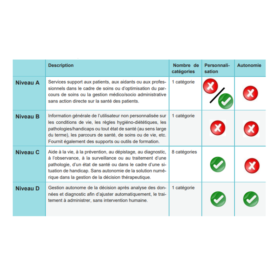
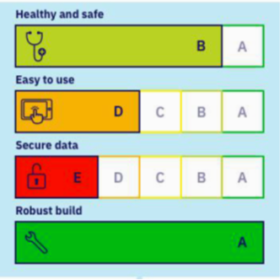
Classification HAS des logiciels de santé
Classification HAS des solutions numériques utilisées dans le cadre de soins médicaux ou paramédicaux
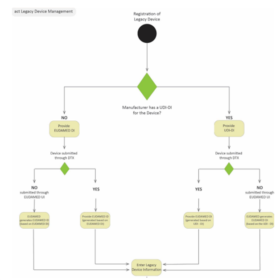
Enregistrement Eudamed des DM déjà CE selon les directives 93/42/CEE, 90/385/CEE et 98/79/CE
Enregistrement des “legacy devices” dans la base Eudamed
Groupes d’expert·e·s pour évaluer les évaluations cliniques
La liste des expert·e·s européen·ne·s du dispositif médical a été publié le 8 février sur le site de la commission, ces expert·e·s ont répondu à.
Informations fournies, bénéfice/risque et acceptabilité : cas des substances dangereuses
Réactions contrastées à un nouveau texte de loi prévoyant l’information des utilisateurs quant aux perturbateurs endocriniens
IEC 62304, nouvelle révision : les évolutions
Changements introduits par la nouvelle révision de la norme IEC 62304
Reconditionnement des appareils électromédicaux, cycle de vie étendu : norme IEC 63120
Processus de reconditionnement des appareils électromédicaux
CNEDIMTS: rapport d’activité 2020
Rapport d’activité 2020 de la CNEDiMTS
Interprétation des changements des dispositifs, en relation avec l’avis d’un organisme notifié
Avis du Team-NB sur les modifications nécessitant un nouvel avis de l’organisme notifié
La PCVRR sous les projecteurs d’Eudamed
Informations publiques et nominatives relatives à la personne chargée de veiller au respect de la réglementation chez une fabricant de DM.
ISO 21801-1 • Prendre en compte les déficiences cognitives pour la conception des produits et services
ISO 21801-1 : Accessibilité cognitive — Partie 1 : Lignes directrices générales
Certifications 2017/745 : embouteillages en vue
Team NB alerte sur la période 2021-2024
Verres et lunettes de lecture : guide MDCG pour l’IUD
Guide MDCG 2020-18
Cybersécurité des logiciels médicaux, présentation de l’IEC 81001-5-1
Présentation de l’IEC 801001-5-1 et des activités nécessaires dans le cadre de la gestion de la cybersécurité des logiciels de santé
UDEM Adriatic d.o.o est notifié pour le règlement DM
Notification de UDEM Adriatic d.o.o pour le règlement (UE) 2017/745.
Mesures temporaires et FAQ : Audits à distance pendant la crise Covid
Modalités et FAQ pour les audits à distance pendant la crise covid
Lancement d’Eudamed
Lancement d’Eudamed et du module d’enregistrement des opérateurs économiques
Eudamed : FAQ sur l’enregistrement des acteurs
FAQ sur le module d’enregistrement des acteurs sur Eudamed.
Projet de décret : gestion des déchets électriques et électroniques des DM perforants (auto-traitement et autotest)
Décret sur la gestion des déchets électriques et électroniques des DM perforants.
Évaluation CNEDiMTS des DM utilisant de l’IA
Évaluation CNEDiMTS des DM utilisant de l’IA : webinaire, guide, faq
Les medtech suisses dans l’attente
Besoin urgent pour la Suisse de mettre à jour les accords avec l’Europe, en contexte dispositifs médicaux.
Guide sur la réglementation MHRA des dispositifs médicaux, à partir du 1ᵉʳ janvier 2021.
Mise à jour de la MHRA concernant la réglementation des DM aux UK, à compter du 1er janvier 2021.
Des nouvelles de l’EN ISO 13485/A1
Des nouvelles de l’amendement pour la norme EN ISO 13485:2016.
Des nouvelles des normes à harmoniser pour le règlement DM
Nouvelles listes des normes à harmoniser pour les règlements 2017/745 et 2017/746.
Nouveau site internet pour le GMED
Lifting du site internet du GMED, qui gagne en contenu et en clarté. Parmi les rubriques utiles : Les accréditations du GMED; Un espace de.
Eudamed : enregistrement des opérateurs économiques
Guide et informations relatives à l’enregistrement des opérateurs économique sur la base Eudamed.
Nouveaux guides HAS pour l’évaluation des dispositifs médicaux
Guide HAS pour le dépôt de dossier de remboursement
Guide relatif aux déclarations d’incidents pour les pompes à insuline
Guide relatif à la vigilance pour les fabricants de pompes à insuline
IEC 62366-1+A1 : Nouveautés et Tarifs
IEC 62366-1/A1 : résumé des changements, comparatif des prix
Oxymétrie de loisir, l’Apple Watch vous prend pour des poires
Nouvelle montre Apple, nouvelle fonctionnalité de santé, nouvelle arnaque médicale
Règlementation et recommandations pour les IA médicales
Réglementations applicables, normes et recommandations pour les fabricants d’intelligences artificielles médicales.
PLFSS 2021 : impact pour les dispositifs médicaux
Impact du PLFSS 2021 sur le remboursement des dispositifs médicaux
Publication de l’IEC 60601-1-2/A1:2020
Amendement 1 de septembre 2020 pour la norme IEC 60601-1-2 : perturbations électromagnétiques – Exigences et essais.
3EC International a.s est notifié pour le règlement DM
Notification de 3EC International a.s pour le règlement (UE) 2017/745
Logiciel d’aide à la prescription : référentiel de certification volontaire HAS version 2020
Version 2020 du référentiel HAS pour les LAP en enquête publique
Rappel : pas de certificat de conformité pour les DM de classe I
Rappel de la MHRA sur la conformité des dispositifs de classe I
Délivrance automatisée d’insuline en DIY : Point de désinformation de l’ANSM
Modification des systèmes de délivrance d’insuline : attention danger
ISO/TR 20416 : Surveillance après commercialisation • Résumé du guide
Résumé du guide ISO/TR 20416 relatif à la surveillance après commercialisation des dispositifs médicaux
Spécifications communes pour le retraitement des dispositifs à usage unique
Règlement d’exécution (UE) 2020/1207 : spécifications communes pour le retraitement des dispositifs à usage unique.
DQS Medizinprodukte GmbH est notifié pour le règlement DM
Notification de DQS Medizinprodukte GmbH pour le règlement (UE) 2017/745
Capacité des organismes notifiés dans le cadre de la lutte contre le coronavirus
Disponibilité et capacité des organismes notifiés à effectuer des évaluations de conformité pour les dispositifs médicaux liés au COVID-19
MDCG 2020-13: Rapport d’évaluation de l’évaluation clinique, la check-list
Grille d’analyse des évaluation cliniques des dispositifs médicaux
Nouveau site de l’UE pour les DM, une veille simplifiée
Nouveau site de l’UE pour les dispositifs médicaux
Le plein de projets de normes
Enquêtes en cours sur les normes utiles dans le médical
Rapport 2019 de l’observatoire des signalements d’incidents de sécurité des systèmes d’information pour le secteur santé
Rapport 2019 sur les incidents de sécurité des systèmes d’information pour le secteur santé
Risques associés aux logiciels médicaux : revue de la littérature
Revue de la littérature de la TGA autour des risques associés aux logiciels médicaux.
Notification du GMED pour le règlement 2017/745
Notification du GMED pour le règlement dispositifs médicaux
Le CEN CENELEC ne veut pas fournir les normes pour les règlements DM et DM-DIV
Règlements DM et DM-DIV : rejet du mandat de normalisation par le CEN CENELEC
Transition règlement : consultation d’une autorité pour les dispositifs combinés
Guide du MDCG pour la consultation d’une autorité dans le cadre de l’évaluation d’un dispositif médical combiné
Renouvellement des désignations des organismes notifiés : règlement d’exécution et guide MDCG
Mesures pour faciliter le renouvellement des désignations des organismes notifiés pendant la crise covid.
Concevoir des services de santé respectant la dignité des personnes âgées
Principes pour des prestations de santé garantissant la dignité des personnes âgées, norme EN 17500
Liste des Normes à harmoniser pour le règlement DM
Mandat de normalisation CEN CENELEC pour les normes harmonisées au règlement (UE) 2017/745
Déclaration d’incident : formulaire et FAQ
Formulaire MIR pour la déclaration d’incidents et FAQ associée
Dérogations pour la mise sur le marché des dispositifs médicaux
Procédure d’autorisation de mise sur le marché de dispositifs médicaux par dérogations aux règles de marquage CE.
Vérifier la conformité d’un certificat CE ou d’un produit
Liens pour identifier les produits frauduleux ou vérifier les certificats CE des dispositifs médicaux et les certificats ISO 13485 des fabricants.
Eudamed : des news
Informations sur la disponibilité des modules Eduamed
Intertek Medical Notified Body AB est notifié pour le règlement 2017/745
Notification de Intertek Medical Notified Body AB pour le règlement (UE) 2017/745
Un Audit Confiné
Déroulement d’un audit à distance en période de confinement, par Benoit Daclin.
Des nouvelles des ON : explosion des RH et baisse des certificats CE et ISO 13485
Rapport team-NB 2019 sur les ressources et activités des organismes notifiés.
MDC MEDICAL est notifié pour le règlement DM
MDC MEDICAL DEVICE CERTIFICATION GMBH, (ON Allemand N°0483) vient d’être notifié pour le règlement 2017/745.
Règlement 2017/745 : calendrier détaillé
Les dates clés pour la mise en oeuvre du règlement (UE) 2017/745
MDCG 2020-6 : preuves cliniques nécessaires pour les DM CE sous les directives
Preuves cliniques nécessaires pour les dispositifs CE selon la directive 93/42/CEE, dans le cadre de la transition au règlement (UE) 2017/745.
Report du règlement (UE) 2017/745
Le règlement (UE) 2017/745 est décalé d’un an.
La HAS propose une nouvelle classification pour les logiciels
Logiciels de santé : classification en niveaux A, B , C et D selon la HAS
Mise à jour des normes harmonisées pour la directive 93/42/CEE : du retard et des oublis
Nouvelles normes harmonisées à la directive 93/42/CEE
CE Certiso Orvos est notifié pour le règlement DM
CE Certiso Orvos, (ON Hongrois N°2409) est notifié pour le règlement (UE) 2017/745.
Mise à jour de l’état d’avancement des évaluations des organismes notifiés pour le règlement DM
Mise à jour du suivi de l’avancement des évaluations des ON, pour leur notification au règlement (UE) 2017/745
MDCG 2020-1: Évaluation clinique des logiciels, principes clés
Principes clés pour l’évaluation clinique des logiciels (de) dispositifs médicaux, selon le guide MDCG 2020-1.
Mesures transitoires pour les dispositifs médicaux de classe I, en vue du règlement
Mesures transitoires pour les dispositifs médicaux de classe I, avant la mise en œuvre du règlement (UE) 2017/745.
MDCG 2020-3 : définition et impact des changements significatifs pendant la période transitoire
Guide pour l’analyse de l’aspect “significatif” des changements apportés à un dispositif médical
Plan conjoint de mise en œuvre du règlement sur les dispositifs médicaux
Plan de mise en œuvre/préparation du nouveau règlement sur les dispositifs médicaux 2017/745. Ce document présente un plan conjoint de la Commission et des États membres, comprenant des actions prioritaires et d’urgence pour mettre en place un système opérationnel d’ici mai 2020.
Cartes d’implants : exigences, modèles et nouveaux symboles
Exigences et modèles pour les cartes d’implant des dispositifs médicaux : carte et livret associé
Coronavirus : impact sur les activités du GMED, IAD ID 3 : Gestion des événements ou circonstances extraordinaires
Mesures du GMED pour la gestion de la crise liée au coronavirus du, focus sur le document IAF ID3.
CR Comité d’interface ANSM / professionnels du DM : Groupe de Travail Eudamed
compte rendu de la réunion du 6 février 2020 Comité d’interface ANSM / Organisations professionnelles Représentatives des industries des DM et des DMDIV : Groupe de Travail Eudamed
Affaire PIP : suite du feuilleton
Suites de l’affaire PIP avec les conclusions de la Cour fédérale de justice allemande
ISO 15223-1:2020 : 23 nouveaux symboles
Nouveaux symboles de la norme ISO 15223-1:2020
Evaluation biologique : ISO 10993-2 et ISO 10993-10 en enquête
Les normes ISO 10993-2 et ISO 10993-10 sont en enquête publique
Proposition de régime réglementaire pour les dispositifs médicaux personnalisés, y compris les dispositifs imprimés en 3D
Proposition de la TGA pour un nouveau régime réglementaire pour les dispositifs médicaux personnalisés, y compris les dispositifs imprimés en 3D.
FAQ : DM sur mesure et DM adaptables
FAQ du MDCG relative aux DM sur mesure et aux DM adaptables
Brexit – Implications pour les produits thérapeutiques en Australie
Résumé de la note de la TGA relative au Brexit. Les informations sont largement valables pour l’Europ
Forfait Innovation – Mise à jour de la procédure
La HAS a mis à jour sa procédure d’élaboration des avis du Collège de la HAS en vue de la prise en charge dérogatoire d’un DM/DMDIV/acte innovant.
Groupe de travail RDM ANSM et Représentants : compte rendu
L’ANSM a publié le compte rendu du Groupe de travail « Règlements DM/DMDIV », associé au Comité d’interface ANSM / Représentants des industries des DM et des DMDIV, qui s’est réuni le 10 septembre 2019.
Projet de loi sur la réglementation Post Brexit des DM
La première lecture du projet de loi sur les médicaments et les DM a été faite à la Chambre des Communes afin de présenter le nouveau cadre que souhaite instaurer le gouvernement britannique en matière de santé.
Remise en bon état d’usage de certains dispositifs médicaux à usage individuel
L’article L5212-1-1 du CSP suit les ambitions de la réfore du financement de système de santé, en encadrant la remise en bon état d’usage de certains DM à usage individuel.
Reconditionnement et réutilisation des dispositifs médicaux
Norme IEC 63120 relative au reconditionnement et la réutilisation des dispositifs (électro)médicaux.
ISO 10993 pour la biocompatibilité
ISO 10993-X pour la biocompatibilité des dispositifs médicaux
Déclaration des ventes 2019 avant le 31 mars 2020
L’ANSM a mis à jour le formulaire de déclaration de ventes annuelles des DM et de DMDIV réalisées en 2019.
La présentation et la notice explicative qui accompagnent le formulaire ont été mises à jour.
Cette déclaration est à effectuer avant le 31 mars 2020 à declarationventes.DM-DMDIV@ansm.sante.fr.
Notification du NSAI pour le règlement (UE) 2017/745
Le National Standards Authority of Ireland vient d’être notifié pour le règlement (UE) 2017/745, les (nombreuses) exclusions sont listées ci-dessous
Programme de travail 2020 de l’Union dans le domaine de la santé
Programme de travail de l’UE dans le domaine de la santé, pour 2020
Avis préliminaire sur la protection des données et la recherche scientifique
Avis préliminaire sur la protection des données pour la recherche scientifique, de l’EDPS.
Orientations pour les fabricants et les ON concernant l’établissement des PSUR
Mise à jour du draft du guide MDCG relatif au PSUR
Notification de DNV GL Presafe AS
Notification de DNV GL Presafe AS pour le règlement (UE) 2017/745
Suppression de la taxe DM, Clause de sauvegarde
Suppression de la taxe sur le chiffre d’affaires des DM et nouvelle taxe pour les DM inscrits sur la liste en sus : la clause de sauvegarde.
Informations sur le Règlement de 2019 modifiant la législation sur les produits thérapeutiques
La TGA a mis en ligne une page expliquant les principales modifications de la règlementation en matière de produits de santé, dont les DM, à l’occasion du premier ensemble de modifications
Déclarations de vente des dispositifs médicaux au CEPS
Formulaire en ligne des déclarations de vente 2019 de dispositifs médicaux
Appel à des experts en dispositifs médicaux et en dispositifs médicaux de diagnostic in vitro
Un appel à experts pour communications sur le RDM est relié par le team NB
Précisions sur la nomenclature CND
Un document de l’UE fournit des précisions sur la nomenclature CND
Précisions sur la nomenclature des dispositifs médicaux
Un document de l’UE apporte des précisions sur la nomenclature EMDN des dispositifs médicaux
MDCG 2019-16 : Guide MDCG relatif à la cybersécurité des dispositifs médicaux : résumé des principes et exigences
Résumé du guide MDCG relatif à la cybersécurité des dispositifs médicaux
«Influenceurs» : Décret n° 2019-1530 du 30 décembre 2019 relatif à la transparence des liens d’intérêts
Le Décret n° 2019-1530 du 30 décembre 2019 relatif à la transparence des liens d’intérêts modifie l’article R1453-3 du CSP
Le décret du 24 décembre 2019 vient modifier la procédure du Forfait Innovation pour les technologies de santé dites de rupture
Publication du Décret n° 2019-1452 du 24 décembre 2019 modifiant les procédures applicables au titre de la prise en charge forfaitaire prévue à l’article L. 165-1-1 du code de la sécurité sociale (forfait innovation)
MEDCERT ZERTIFIZIERUNGS est notifié pour le règlement (UE) 2017/745
L’organisme MEDCERT ZERTIFIZIERUNGS- UND PRÜFUNGSGESELLSCHAFT FÜR DIE MEDIZIN GMBH vient d’être notifié pour le règlement dispositifs médicaux.
Mise à jour de la feuille de route du MDCG : décalages et nouveautés
Le MDCG a mis à jour sa feuille de route, les changements sont identifiés ci-dessous
Principaux changements causés par le RDM en matière d’investigation clinique
Le CCMO a publié une liste des principaux changements causés par le RDM en matière d’investigation clinique, il sont résumés ci-dessous.
Mise à jour du “rolling plan” pour la mise oeuvre des RDM et RDM-DIV
Le rolling plan proposé par l’UE a été mis à jour, il fait le point sur les étapes achevées et à venir pour la mise en application des règlements DM et DM-DIV.
Fiche d’information : Modification des modalités de facturation des dispositifs médicaux implantables (DMI) inscrits sur la liste en sus
Le ministère de la santé a diffusé une fiche d’information relative à la modification des modalités de facturation des dispositifs médicaux implantables inscrits sur la liste en sus.
Révisions 2019 des normes ISO 10993-7, ISO 10993-9 et ISO 10993-15 : les changements
Nouvelles publications pour 3 normes relatives à l’évaluation biologique :
ISO 10993-7:2008/Amd 1:2019 – Évaluation biologique des dispositifs médicaux — Partie 7: Résidus de stérilisation à l’oxyde d’éthylène — Amendement 1
ISO 10993-15:2019 – Évaluation biologique des dispositifs médicaux — Partie 15: Identification et quantification des produits de dégradation issus des métaux et alliages
ISO 10993-9:2019 – Évaluation biologique des dispositifs médicaux — Partie 9: Cadre pour l’identification et la quantification des produits potentiels de dégradation
Remplacement des codes de descriptions génériques par les codes d’identification individuelle au 1er janvier 2020
L’arrêté du 10 décembre 2019 remplace, à compter du 1er janvier 2020, les codes LPP attachés à certaines descriptions génériques par les codes d’identification individuelle.
Le parlement approuve le 2nd rectificatif au règlement (EU) 2017/745
Le parlement adopte le 2nd rectificatif au règlement (EU) 2017/745 relatif aux dispositifs médicaux
ISO 14971:2019 : des changements modestes
Publication de l’ISO 14971:2019
Notification de DEKRA Certification B.V.
DEKRA Certification B.V. vient d’être notifié pour le règlement (UE) 2017/745, les exclusions sont listées ci-dessous
Guide relatif aux codes de DM
Guide du MDCG définissant les codes MDA, MDN, MDT et MDS ainsi que leur utilité
Guide sur l’échantillonnage des DM Classe IIa et IIb
Guide du MDCG relatif à l’échantillonnage des dispositifs médicaux de classe IIa et IIb, pour l’évaluation par les ON
Lignes directrices à l’intention des fabricants pour satisfaire aux exigences de l’article 78 de la directive 96/29/Euratom qui fixe les normes de radioprotection
“Lignes directrices à l’intention des fabricants” pour satisfaire aux exigences de l’article 78 de la directive 2013/59 « fixant les normes de base relatives à la protection sanitaire contre les dangers résultant de l’exposition aux rayonnements ionisants »
Nouveaux documents relatifs à l’IUD : Formats selon les différentes entités émettrices
De nouveaux documents sont disponibles sur le site de la commission, ils donnent des informations très techniques sur l’IUD : le format des codes et les éléments que vous pourrez utiliser pour l’étiquetage des dispositifs.
Rumeurs de notification pour Dekra NL !
Dekra NL serrait notifié pour le RDM d’ici quelques jours.
Le CAMD s’émeut du décalage d’Eudamed
Le CAMD a publié un courrier dans lequel il s’inquiète de la situation engendrée par le décalage de deux ans d’Eudamed : résumé des points durs et des propositions.
Nouveau format pour le résumé des références des normes harmonisées publiées au Journal officiel
Présentation du nouveau format pour la liste des normes harmonisées UE
Livre blanc sur le règlement (UE) 2017/746 relatif aux DM-DIV
Livre blanc du BSI relatif aux règlement DM-DIV et à ses conséquences
Le draft du corrigendum v2 du RDM est disponible !
Le draft du second correctif pour le règlement (UE) 2017/745 est disponible. Attention : il doit encore être approuvé. Modifications Rendez-vous à la page 49.
Enquête publique : IEC 80001-1 Gestion des risques des DM connectés
Norme IEC 80001-1 pour la gestion des risques des dispositifs médicaux connectés à des IT
Mise à jour du Guide intra-GHS
La HAS vient d’actualiser son guide intra-GHS destiné aux dispositifs médicaux à usage individuel qui sont utilisés en établissement de santé et qui sont financés au travers des prestations hospitalières par une enveloppe globale au titre des Groupes Homogènes de Séjour (intra-GHS).
Guide pour l’investigation clinique : Revue des modifications
Revue des changements du guide IMRDF pour les investigations cliniques sur les dispositifs médicaux
Guide IMDRF pour l’évaluation clinique : Revue des modifications
L’IMDRF a mis à jour son guide lié à l’évaluation : liste des modifications
Mise à jour du guide IMDRF lié à l’évaluation clinique : définitions et concepts clés
Mise à jour du guide IMDRF lié à l’évaluation clinique et ses définitions et concepts clé, ayant pour base la version de 2007 (GHTF/SG5/N1R8:2007) encore sous format GHTF
Nouveau Portail MedimedDM et dématérialisation partielle des dossiers de prix LPP
Le CEPS a développé la plateforme numérique MedimedDM pour faciliter le dépôt des dossiers relatifs aux DM et prestations en vue de leur inscription sur.
Ministère de la Santé : Nouveaux codes individuels LPP
Le ministère de la santé a publié le tableau Excel indiquant les nouveaux codes individuels LPP attribués à chaque fabricant qu’il a lui-même déclaré sur.
BSI Group The Netherlands B.V. est notifié pour le règlement DM
BSI Group The Netherlands B.V. vient d’être notifié pour le règlement RDM
DARE!! Services B.V. est notifié pour le règlement DM
DARE!! Services B.V. vient d’être notifié pour le règlement RDM.
Mise à jour du Guide LPPR
La HAS met à jour le Guide pour le dépôt d’un dossier auprès de la CNEDiMTS (octobre 2019), ainsi que la matrice du dossier. Pour.
Ministère de la Santé : Identification individuelle des DM – Update des dates d’entrée en vigueur du décret 2019-571
Le ministère de la santé a mis à jour la page internet dédiée à l’identification individuelle pour une inscription en ligne générique des dispositifs médicaux..
Fiche pratique : e-santé
Fiche pratique HAS : télémédecine, applis et objets connectés de santé, certification des logiciels métiers (LAP et LAD)
Eudamed décalé de deux ans [mise-à-jour]
Eudamed décalé de 2 ans.
Découplage de la norme ISO 14971 des accords de Vienne
Découplage de la norme ISO 14971:2019 des accords de Vienne
MDCG 2019-11 : qualification et la classification des logiciels selon le règlement dispositifs médicaux
Revue, résumé et analyse du guide du MDCG pour les logiciels dispositifs médicaux : qualitfication et classification des softs
Mise à jour de la FAQ sur les organismes notifiés
Mise à jour de la FAQ du MDCG pour les organismes notifiés
Guide : exigences directive machine vs RDM
Le document du COCIR qui mettant en regard exigences de la directive machine et exigences du RDM.
Application des dispositions transitoires concernant la validité des certificats délivrés conformément aux directives 90/385/CEE et 93/42/CEE
Guide relatif à l’application des dispositions transitoires concernant la validité des certificats délivrés conformément aux directives 90/385/CEE et 93/42/CEE
Guide pour la cybersécurité
Guide de l’IMDRF pour la cybersécurité des dispositifs médicaux
Mise à jour du formulaire MIR pour la déclaration des incidents graves
Le formulaire MIR passe en 7.2
Formulaire : groupe d’experts sur les DM et DM-DIV
formulaire pour répondre à l’appel à manifestation d’intérêt pour les groupes d’experts sur les dispositifs médicaux
Dispositifs “bien-être”/”wellness” présentant un faible risque
Définition de dispositif wellness/bien-être selon la FDA
Brexit et impact en Irlande, attention aux stocks de DM
Notice de la HPRA relative à l’impact du Brexit sur le secteur des dispositifs médicaux et les risques de pénurie associés
Appel à manifestation d’intérêt en vue de la constitution de groupes d’experts sur les DM et les DM-DIV
Publication d’un appel à manifestation d’intérêt en vue de la constitution de groupes d’experts européens sur les dispositifs médicaux et DM-DIV
Guide relatif aux déclarations d’incidents pour les implants mammaires
Guide du MDCG relatif à la déclaration des incidents liés aux implants mamaires
Guide relatif aux déclarations d’incidents pour les implants cardiaques actifs
Guide du MDCG relatif à la déclaration des incidents pour les DM implantables actifs (pacemakers, sondes, défibrilateurs, …)
Nouveau format DICOM RTV
Nouveau format DICOM-RTV pour les applications vidéos médicales
Une personne responsable bientôt nécessaire aux UK
La MHRA a mis à jour ses consignes en vue du hard Brexit, un guide détaille le rôle de la personne responsable, un rôle rendu.
Guide du MDCG pour le RCSPC
Résumé du guide du MDCG pour le RCSPC
TÜV Rheinland est notifié pour le règlement 2017/745
TÜV Rheinland devient le cinquième organisme à être notifié pour le règlement (ue) 2017/745
FAQ de Medtech Europe pour les RDM et RDM-DIV
Medtech Europe a publié une FAQ sur le rôle des opérateurs économiques dans les règlements DM et DMDIV Résumé 1. Le fabricant ou l’importateur devrait-il.
Rôles et exigences pour les groupes européens d’experts dans le domaine des dispositifs médicaux
La décision d’exécution 2019/1396 a été publiée le 10 septembre 2019, elle précise les critères pour la désignation de groupes d’experts dans le domaine des.
UE : Les dispositifs médicaux passent de l’industrie à la santé
L’exécutif européen a changé de têtes, Ursula von der Leyen devient, depuis juillet, la présidente de la commission européenne et Stella Kyriakides, psychologue clinicienne chypriote,.
Lignes directrices pour l’évaluation du rapport bénéfice/risque lié à la présence de phtalates dans certains dispositifs médicaux
[article initialement publié le 20 mars 2019, mis à jour le 10 septembre 2019] Le SCHEER vient de publier la version finale de ses lignes.
Prise en compte des approches relatives au rapport bénéfice/risque, exemple des appareils de perte de poids
Nouveau document de travail de la FDA, dédié aux dispositifs destinés à la perte de poids il fournit néanmoins des idées généralisables sur l’évaluation du.
Brexit dur et impact pour les DM
Avec la nomination de Boris JOHNSON au poste de Premier ministre (en remplacement de Theresa MAY) et compte tenu de son affirmation selon laquelle Brexit.
Essais cliniques – Mise à jour du courrier de demande d’autorisation
Les demandes d’autorisation d’essai clinique (AEC) doivent se faire auprès de l’ANSM via un modèle de courrier « Courrier de demande d’autorisation d’essai clinique portant.
Livre blanc du BSI sur la gestion des risques et l’ISO 14971:2019
BSI fait le point sur l’ISO 14971 et sa future révision dans un nouveau livre blanc. Notez que la publication de la norme est imminente,.
IMQ s.p.a. est notifié pour le règlement 2017/745
[EDIT : article initialement publié le 16/08/2019, mise à jour avec la publication de la notification sur NANDO le 20/08/2019] Le ministère de la santé.
Loi relative à l’organisation et à la transformation du système de santé : impact pour le secteur des dispositifs médicaux
La loi n° 2019-774 du 24 juillet 2019 relative à l’organisation et à la transformation du système de santé a été adopté le 26 juillet.
Qualité de l’eau utilisée en retraitement des dispositifs médicaux
L’INSPQ vient de publier un guide relatif à la qualité de l’eau utilisée en retraitement des dispositifs médicaux réutilisables. Ce guide est destiné aux établissements.
Transfert de certificat des ON dans le cadre du Brexit
La commission a publié un document faisant l’état des lieux de la préparation des mesures d’urgence en vue du Brexit, il y est précisé que.
Enquête publique : IEC 60601-1-8/A2
La norme IEC 60601-1-8/AMD2 (alarmes des dispositifs électromédicaux) est en enquête publique. Notez que l’amendement étant conséquent, il est possible que la norme soit révisée plutôt.
Enquête publique : EN ISO 11737-1/A1
La norme NF EN ISO 11737-1/A1 “Stérilisation des produits de santé — Méthodes microbiologiques — Partie 1 : Détermination d’une population de microorganismes sur des produits.